题目内容
【题目】某化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,将 200g 稀盐酸平均分成 4 等分,分别加入样品中,充分反应后称得生成气体质量,得到的实验数据如下:
第一次 | 第二次 | 第三次 | 第四次 | |
样品质量(g) | 5 | 10 | 15 | 20 |
稀盐酸质量(g) | 50 | 50 | 50 | 50 |
生成气体质量(g) | 1.76 | 3.52 | 4.4 | m |
(1)表中 m= 。
(2)第一次反应后所得溶液中的溶质是 (填化学式)。
(3)计算该石灰石样品中碳酸钙的质量分数 ?
【答案】(1)4.4;(2)CaCl2和HCl;(3)80%
【解析】
该反应原理是碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水。
(1)稀盐酸每份质量都是50g,石灰石样品的质量第一次5g,生成1.76g二氧化碳气体;第二次石灰石样品10g,生成二氧化碳3.52g,样品加倍10g÷5g=2,生成的二氧化碳也加倍3.52÷1.76=2,按照这个关系,第三次样品15g时,15g÷5g=3,生成氧气的质量也应该是第一次二氧化碳质量1.76g的三倍。实际上第三次生成的二氧化碳质量4.4g,不够1.76g的三倍,说明盐酸的量不够了,即50g稀盐酸最多生成4.4g二氧化碳。所以第四次样品质量为20g(过量)时,盐酸还是只有50g,生成二氧化碳的质量还是4.4g。故填:4.4。
(2)由(1)分析可得,盐酸50g最多可生成4.4g二氧化碳,第一次样品5g,只生成1.76g二氧化碳,样品不足,盐酸过量,所以溶质成分有生成的氯化钙和过量的盐酸。故填:CaCl2和HCl。
(3)第一次和第二次的石灰石样品完全参加反应,故求石灰石样品中碳酸钙的质量,可以按第一次或第二次计算。本解析按第一次。设5g石灰石样品中含碳酸钙的质量为x,
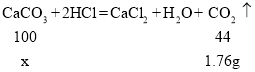
![]()
解得:x=4g。
![]()
答:该石灰石样品中碳酸钙的质量分数为80%。

 阅读快车系列答案
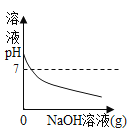
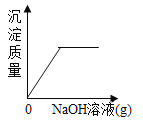
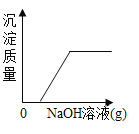
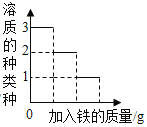
阅读快车系列答案【题目】如图所示图像中,能正确反映对应变化关系的是
A | B | C | D |
|
|
|
|
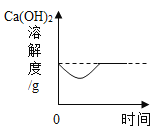
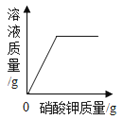
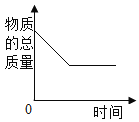
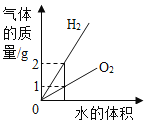
向饱和石灰水中加入一定量CaO | 一定温下,向不饱和硝酸钾溶液中加入硝酸钾固体 | 一定质量的红磷在密闭容器内燃烧 | 电解水生成氢气和氧气质量 |
A. A B. B C. C D. D