题目内容
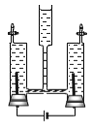
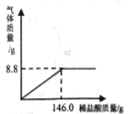
【题目】菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中MgCO3的含量,学习小组进行了实验研究.取10克菱镁矿样品,向其中逐滴加入未知质量分数的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如表:
加入H2SO4溶液的质量/g | 50 | 100 | 150 | 200 |
NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
(假设菱镁矿中的杂质不溶于水,不与酸发生反应.)
(1)10克菱镁矿与H2SO4溶液完全反应,生成CO2的质量为_____.
(2)该菱镁矿中MgCO3的质量分数是多少?____
(3)该实验研究中所用H2SO4溶液的溶质质量分数是多少?____
【答案】4.4g 84% 9.8%
【解析】
(1)表中信息可知10g菱镁矿与H2SO4溶液完全反应,生成CO2的质量为4.4g;
(2)设菱镁矿中MgCO3的质量为x,所用H2SO4溶液的溶质的质量分数是y,生成MgSO4的质量为z;
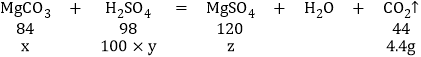
![]()
x=8.4g,y=9.8%,z=12g
菱镁矿中碳酸镁的质量分数:![]() ×100%=84%;
×100%=84%;
(3)实验研究中所用H2SO4溶液的溶质质量分数是y=9.8%。

【题目】某化学实验小组的同学利用如图所示装置进行实验。A中反应开始时,弹簧夹C处于打开状态。一段时间后,关闭C,装置A中仍在反应。过一会儿,观察到装置A中液体通过长导管进入装置B,装置B中出现白色沉淀,装置A中液体能进入装置B的原因:____________,装置B中出现白色沉淀的化学反应方程式为____________。小组同学探究反应后装置B中溶液的溶质成分。
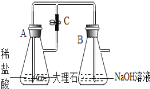
(提出问题)反应后装置B溶液的溶质成分是什么?
(猜想与假设)猜想1:NaCl、CaCl2 猜想2:NaCl、HCl; 猜想3:NaCl、NaOH; 猜想4:NaCl、NaOH、Na2CO3。
(交流讨论)经讨论,大家一致认为猜想________一定不合理。理由是________。
(实验探究)将反应后装置B中所得混合物过滤,取少量滤液分别进行如下实验:
实验1:向滤液中滴加碳酸钠溶液,无明显现象,则猜想________不正确。
实验2:小王通过进一步的实验证明猜想4正确,请你在下面的横线上帮他补全实验操作和现象。
实验操作 | 实验现象 | 实验结论 |
取少量滤液于试管中,然后先滴加少量无色酚酞试液,再加入______溶液。 | _______ | “猜想4”成立 |
(拓展延伸)小田完成一道类似的家作时得了满分。请你认真分析后写出答案。取6g部分变质的NaOH固体样品,加人73g溶质的质量分数为10%的稀盐酸充分反应,测得pH小于7,再滴加8mL的NaOH溶液,测得pH恰好为7,蒸发所得的溶液,得到的晶体的质量为_____。
【题目】如图的加热袋常用于野外加热食物。加热袋中的固体粉末含镁粉、铁粉和氯化钠,使用时向其中加入水袋中的水,即可产生大量热。实验小组针对放热过程中的反应原理展开探究。


【查阅资料】
常温下镁粉能与水发生置换反应,且放热。
【进行实验】
同学们用下图所示装置进行模拟实验:分别取不同成分的固体粉末放入甲中,通过分液漏斗向其中均加入8 mL水,读取甲中所得固液混合物的最高温度,实验记录如下表:
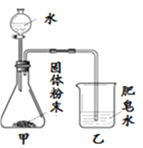
(实验时的室温为22.8℃)
实验序号 | A | B | C | D | E | F |
固体成分 | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
乙中现象 | 少量肥皂泡,难以点燃 | ______ | 少量肥皂泡,难以点燃 | 较多肥皂泡,点燃有爆鸣声 | 无肥皂泡 | 大量肥皂泡,点燃有爆鸣声 |
混合物温度 | 23.1℃ | 22.8℃ | 23.1℃ | 24.2℃ | 22.8℃ | 27.2℃ |
【解释与结论】
(1)实验B,乙中现象为_______________。
(2)实验A证明了镁粉与水能反应,完成该反应的化学方程式Mg+2H2O=____+H2 ![]() 。
。
(3)使镁粉与水迅速反应并放热的最佳方法是向镁粉中加入_____________。
【反思改进】
(4)同学们分析实验数据发现,升高的温度没有达到食品加热袋的效果,其可能的原因是___________。
(5)同学们根据实验结果进一步猜测,实验F中的反应结束后,甲中剩余固体混合物中仍然含有铁粉,检验其铁粉存在的的验方案为:取少量固体混合物________。
(6)从上述实验初步得出“NaCl溶于水没有热量的变化”的结论,依据的两个实验是(填实验序号)______________。