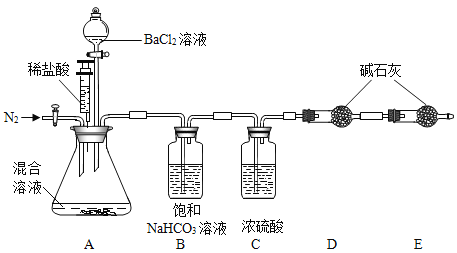
题目内容
【题目】食品包装中常使用一种“504双吸剂”做为保鲜剂,其成分为铁粉、生石灰等。其可用于食品保鲜的原因是可以吸收_______(写出一种物质化学式即可), 实验小组同学对一包使用过的“504双吸剂”进行了如下探究。
[提出问题]使用后固体的成分是什么?
[查阅资料]Fe+2FeCl3=3FeCl2
[进行猜想]固体成分可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。(其它不考虑)
[进行实验]
甲同学的实验记录:
实验操作 | 实验现象 | 实验结论 |
取少量固体放入试管中,滴加一定量的______,用带导管的单孔塞塞紧试管口,导管另一端伸入澄清石灰水中。 | 试管中 固体逐渐减少,有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊。 | 固体中一定含有____,不含Fe2O3。 |
取少量固体放入试管中,加水溶解,静置后取上层清液滴加无色酚酞溶液。 | 试管底部有不溶物,____。 | 固体中含有氧化钙和氢氧化钙。 |
[实验质疑]你认为甲同学得出的实验结论是否正确,并阐述理由:______。
乙同学的实验:
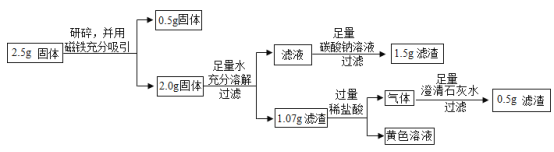
上述实验过程中加足量碳酸钠溶液时发生反应的化学方程式为_____。
[定量计算]计算乙同学实验中2.5g固体中氧化铁的质量?_____
[反思与评价]
依据甲、乙同学的实验,得出的下列结论中,正确的是_____(填字母序)。
A 甲同学实验中得到的浅绿色溶液中溶质一定有FeCl2、CaCl2
B 乙同学实验过程中共有3个反应发生
C 乙同学实验中得到的黄色溶液中溶质为FeCl3、CaCl2
D 甲、乙两位同学实验中都有气体产生,但生成的气体成分不同
【答案】H2O(或O2) 稀盐酸 Fe和CaCO3 试管壁有热感,溶液由无色变成红色。 不正确,氧化铁和盐酸反应生成的氯化铁,可能会继续与铁反应生成氯化亚铁,因此不能说明固体中没有Fe2O3;氧化钙和水反应能生成氢氧化钙(属于碱),滴加无色酚酞溶液后溶液一定会变为红色,因此不能证明固体中有氢氧化钙。 Ca(OH)2+Na2CO3═CaCO3↓+2NaOH 0.57g。 A D
【解析】
铁粉能吸收水和氧气与其反应,氧化钙能与水反,使食品保持干燥和缺氧状态,从而延长保质期。故填:H2O(或O2)。
[进行实验]
由题目中可知固体成分可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3,由表中实验现象:“试管中固体逐渐减少,有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊。”说明固体和一种物质反应生成了二氧化碳气体(澄清石灰水变浊的气体),和一种含有Fe2+的物质(得到浅绿色溶液),能反应产生CO2的物质在里面只有CaCO3可以,且需和酸发生反应,常用的酸是稀盐酸和其反应,而铁也可以和稀盐酸反应生成氯化亚铁和氢气,其化学方程式为:Fe+2HCl═FeCl2+H2↑,可以推出加入的这种物质为稀盐酸,固体物质中一定有的物质是Fe和CaCO3;其他的固体物质中可以和稀盐酸反应的有:①氧化钙和盐酸反应生成氯化钙(溶液为无色)和水,其反应化学方程式为:CaO+2HCl═CaCl2+H2O;②氢氧化钙和盐酸反应生成氯化钙(溶液为无色)和水,其反应的化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;③氧化铁和盐酸反应生成氯化铁(溶液为黄色)和水,其反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O。由于最后所得溶液没有显黄色,也就是溶液中没有,所以固体物质中一定没有Fe2O3。故填:稀盐酸;Fe和CaCO3。
由实验结论中:“固体中含有氧化钙和氢氧化钙。”加水溶解后,氧化钙可和和水反应生成氢氧化钙,同时反应放出大量的热,生成的氢氧化钙的溶液呈碱性,能使无色的酚酞试液变成红色;故填:试管壁有热感,溶液由无色变成红色。
[实验质疑]
由于氧化铁和盐酸反应生成的氯化铁,可能会继续与铁反应生成氯化亚铁,因此不能说明固体中没有Fe2O3;氧化钙和水反应能生成氢氧化钙(属于碱),滴加无色酚酞溶液后溶液一定会变为红色,因此不能证明固体中有氢氧化钙,所以甲同学得出的结论不正确;故填:不正确,氧化铁和盐酸反应生成的氯化铁,可能会继续与铁反应生成氯化亚铁,因此不能说明固体中没有Fe2O3;氧化钙和水反应能生成氢氧化钙(属于碱),滴加无色酚酞溶液后溶液一定会变为红色,因此不能证明固体中有氢氧化钙。
乙同学:
由于固体成分可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3,能够被磁铁吸引的0.5g固体是铁,剩余的2.0g固体中还可能含有Fe2O3(不溶于水)CaO[能和水反应生成Ca(OH)2]、Ca(OH)2(微溶于水,加足量的水后完全溶解)和CaCO3(不溶于水),所以滤液的成分为Ca(OH)2,氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,其化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;故填:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH。
[定量计算]
剩余的1.07g滤渣中的物质可能为:Fe2O3和CaCO3,加入过量的盐酸后发生后生成的黄色溶液(Fe2O3+6HCl═2FeCl3+3H2O)和无色气体(CaCO3+2HCl═CaCl2+H2O+CO2↑),说明固体是含有:Fe2O3和CaCO3;其中CaCO3与稀盐酸反应的CO2又全部被Ca(OH)2转化为CaCO3,因此二者的质量相同,即原先滤渣中有0.5g的CaCO3,则Fe2O3的质量=1.07g-0.5g=0.57g。故填:0.57g。
[反思与评价]
A、由甲同学实验中分析可知浅绿色溶液中溶质一定有FeCl2、CaCl2;故A正确;
B、由乙同学分析中可知发生的反应有:氧化钙和水反应;氢氧化钙和碳酸钠反应;氧化铁和盐酸反应;碳酸钙和盐酸反应共4个反应;故B错误;
C、由乙同学分析中可知乙同学实验中得到的黄色溶液中溶质有FeCl3、CaCl2,由于加入的是过量的稀盐酸,因此里面的溶质还有HCl,故C错误;
D、由甲同学分析中可知甲同学实验中产生的气体为氢气和二氧化碳气体两种,由乙同学分析①中可知乙同学实验中产生的气体为二氧化碳气体所以生成的气体成分不同;故D正确。
故选:A D。

【题目】下面是同学们测定黄铜(铜锌合金)中铜的质量分数的过程。
(1)小华同学取10g黄铜,加入足量的稀硫酸,共收集到气体0.2g,则黄铜中铜的质量分数是多少?____________________(写出计算过程)
(2)小婷同学另取10g黄铜于烧杯中,向烧杯中加入稀硫酸,测得加入的稀硫酸质量和烧杯中剩余物的质量如下表:
加入稀硫酸的质量/g | 30 | 60 | 90 | 120 |
烧杯中剩余物的质量/g | 39.94 | m | 99.82 | 129.8 |
①表中m=____________,从表中的数据分析,当小婷同学加入_________g稀硫酸时,烧杯中刚好没有气泡产生。
②请在下图画出10g黄铜加入稀硫酸与生成氢气的质量的图像____________________。
【题目】下列物质提纯所用的实验不正确的是
选项 | 物质(括号内为杂质) | 实验方法 |
A | CuO(Cu) | 在氧气流中充分加热 |
B | Fe(Al2O3) | 加入足量稀硫酸,充分反应后结晶 |
C | H2(HCl) | 通过装有NaOH 溶液的洗气瓶 |
D | KNO3 溶液(K2SO4) | 加入适量的 Ba(NO3)2 溶液,过滤 |
A.AB.BC.CD.D