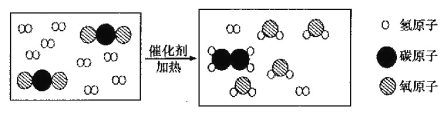
题目内容
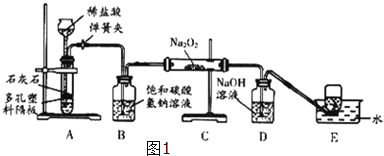
【题目】(10分)实验设计是化学实验的重要环节。请根据下列实验要求回答相关问题: 【活动与探究一】用对比实验方法探究二氧化碳的性质。
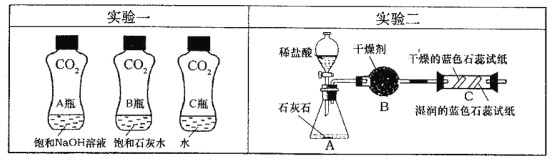
(1)实验一中振荡3个矿泉本塑料瓶,观察到塑料瓶变瘪的程度为A > B > C,其中变浑浊的瓶内发生反应的化学方程式为_ ;对比A瓶与_ (填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应。
(2)实验二观察到C装置中发生的现象是__ 结论是_
(用化学方程式表示)。
【活动与探究二】用变量控制方法探究影响物质溶解性的因素。
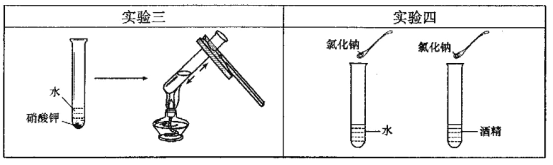
(3)实验三目的是探究 对硝酸钾溶解性的影响;实验四是探究溶剂种类对物质溶解性的影响,该实验中需要控制的变量是温度和.
【活动与探究三】定量测定空气中氧气的含量。
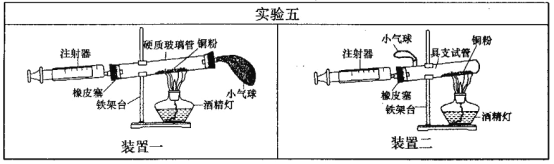
(4)实验五中,反应的原理为__ (用化学方程式表示);装置一比装置二更合理,理由是_ ;
根据下表提供的实验数据,完成下表:
硬质玻璃管 的容积 | 反应前注射器中 气体体积 | 反应后注射器中 气体体积 | 实验测得空气中氧气 的体积分数 |
30mL | 20mL | 12 mL |
定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果 _ (填“偏小、‘偏大”或“无影响”)。
【答案】
(1)Ca(OH)2+CO2==CaCO3↓+H2O C
(2)干燥的石蕊试纸不变色;湿润的石蕊试纸变红。 CO2+H2O==H2CO3
(3)温度 溶剂的质量
(4)2Cu+O2 2CuO;
可使空气更易流通,全部通过铜粉,使氧气与铜粉充分反应。 16%;
(2)偏小。
【解析】
试题分析:(1)二氧化碳可与氢氧化钙溶液反应生成不溶于水的碳酸钙,从而观察到瓶内变浑浊;A中二氧化碳可与氢氧化钠反应,为了排除溶液中水的影响,所以应与C瓶对比。
(2)A生成的二氧化碳经B干燥后进入C中。干燥的二氧化碳不能使石蕊变色;当二氧化碳遇到湿润的试纸时,会与水反应生成碳酸,从而使石蕊变红。所以会观察到:干燥的石蕊试纸不变色;湿润的石蕊试纸变红。反应的化学方程式为:CO2+H2O==H2CO3
(3)实验三中对盛有未完全溶解的硝酸钾的试管进行加热,可探究温度对硝酸钾溶解性的影响;实验四探究的是溶剂的种类对氯化钠溶解性的影响,所以应控制温度和溶剂的质量相等。
(4)实验中利用了铜和氧气的反应,反应的化学方程式为:2Cu+O2 2CuO;
在实验过程中可通过推拉注射器使气体流通,让空气中氧气与氧化铜充分接触;以与氧化铜充分反应。气球的作用是当推拉注射器时保证装置的密封性。所以装置一中气球的位置更合理,可以使空气更易流通,全部通过铜粉,使氧气与铜粉充分反应。
根据题意可知:反应前玻璃管和注射器中均为空气,总体积为30ml+20ml=50ml。反应后气体减少的体积为20ml—12ml=8ml。所以可计算出空气中氧气的体积分数为:![]() ×100%=16%;
×100%=16%;
(2)由于反应前气球内有气体,而在反应后挤入注射器内,所以会造成测得的反应后的剩余气体增多。则计算出气体的减少值(反应的氧气的量)偏小;所以会造成结果偏小。

 阅读快车系列答案
阅读快车系列答案