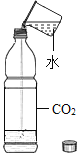
题目内容
【题目】实验室有一瓶含有K2CO3和K2SO4的混合溶液,某化学兴趣小组设计实验来测定溶质的质量分数。他们经过讨论后设计了如下装置进行实验探究:
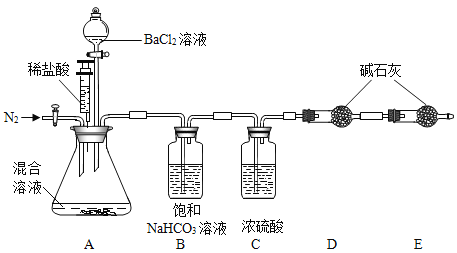
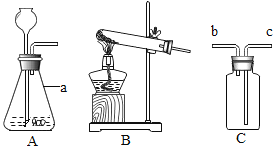
a.按图组装仪器,检查气密性,把100g混合溶液加入锥形瓶中装好药品;
b.打开A中活塞,通入N2一段时间,再关闭活塞,称D装置质量m1克;
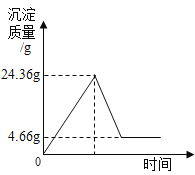
c.逐滴加入BaCl2溶液至不再产生沉淀;关闭分液漏斗,再用针筒打入稀盐酸,至不再产生气体,实验过程中测得锥形瓶中沉淀的数据如下图;
d.打开A中活塞,缓缓通一会儿N2。
e.再称得D装置的质量为m2克;
请你根据题意回答下列问题:
(1)24.36g沉淀中含有什么物质(填化学式)_____,针筒注入稀盐酸产生气体的方程式:_____。
(2)求原混合液中K2SO4的质量分数_____。
(3)小明略加思考后说,通过D装置的质量变化可以求出混合溶液中K2CO3的质量分数,结果_____(填“偏大”、“不变”或“偏小”),理由_____。
【答案】BaCO3、BaSO4 BaCO3+2HCl=BaCl2+H2O+CO2↑ 3.48% 偏大 盐酸挥发出HCl气体与NaHCO3溶液反应产生CO2一并被D装置吸收了,CO2的质量增大,则K2CO3的含量增大
【解析】
(1)根据氯化钡溶液和碳酸钾溶液反应生成碳酸钡沉淀和氯化钾,反应的化学方程式为:K2CO3+BaCl2=BaCO3↓+2KCl;氯化钡溶液和硫酸钾溶液反应生成硫酸钡沉淀和氯化钾,K2SO4+BaCl2=BaSO4↓+2KCl,所以24.36g沉淀中含有碳酸钡和硫酸钡;盐酸和碳酸钡反应生成氯化钡、水和二氧化碳,反应的化学方程式为:BaCO3+2HCl=BaCl2+H2O+CO2↑;故填:BaCO3、BaSO4;BaCO3+2HCl=BaCl2+H2O+CO2↑;
(2)硫酸钡不溶于稀盐酸,所以由图像可知4.66g沉淀就是生成的硫酸钡沉淀。
设硫酸钾的质量为x。
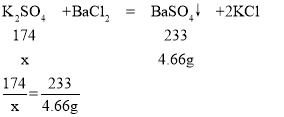
x=3.48g
原混合液中K2SO4的质量分数=![]() ×100%=3.48%
×100%=3.48%
答:原混合液中K2SO4的质量分数为3.48%。
(3)碳酸氢钠溶液在吸收氯化氢的同时新生成了二氧化碳造成干扰,所以通过D装置的质量变化求出混合溶液中K2CO3的质量分数会偏大。故填:偏大;盐酸挥发出HCl气体与NaHCO3溶液反应产生CO2一并被D装置吸收了,CO2的质量增大,则K2CO3的含量增大。

【题目】食品包装中常使用一种“504双吸剂”做为保鲜剂,其成分为铁粉、生石灰等。其可用于食品保鲜的原因是可以吸收_______(写出一种物质化学式即可), 实验小组同学对一包使用过的“504双吸剂”进行了如下探究。
[提出问题]使用后固体的成分是什么?
[查阅资料]Fe+2FeCl3=3FeCl2
[进行猜想]固体成分可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。(其它不考虑)
[进行实验]
甲同学的实验记录:
实验操作 | 实验现象 | 实验结论 |
取少量固体放入试管中,滴加一定量的______,用带导管的单孔塞塞紧试管口,导管另一端伸入澄清石灰水中。 | 试管中 固体逐渐减少,有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊。 | 固体中一定含有____,不含Fe2O3。 |
取少量固体放入试管中,加水溶解,静置后取上层清液滴加无色酚酞溶液。 | 试管底部有不溶物,____。 | 固体中含有氧化钙和氢氧化钙。 |
[实验质疑]你认为甲同学得出的实验结论是否正确,并阐述理由:______。
乙同学的实验:
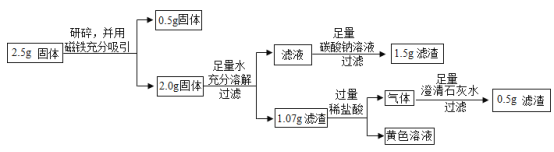
上述实验过程中加足量碳酸钠溶液时发生反应的化学方程式为_____。
[定量计算]计算乙同学实验中2.5g固体中氧化铁的质量?_____
[反思与评价]
依据甲、乙同学的实验,得出的下列结论中,正确的是_____(填字母序)。
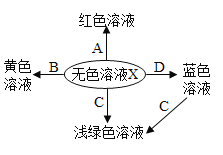
A 甲同学实验中得到的浅绿色溶液中溶质一定有FeCl2、CaCl2
B 乙同学实验过程中共有3个反应发生
C 乙同学实验中得到的黄色溶液中溶质为FeCl3、CaCl2
D 甲、乙两位同学实验中都有气体产生,但生成的气体成分不同