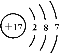题目内容
【题目】小明和小红同学用打磨过的大小相同的铝片分别与pH相同的稀盐酸、稀硫酸反应(装置和现象记录如下图表格),请你与他们一起探究。
时间 | 1 | 2 | 5 | 15 | 20 |
稀盐酸现象 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 反应结束 |
稀硫酸现象 | 无明显现象 | 无明显现象 | 极少量气泡 | 少量气泡 | 少量气泡 |
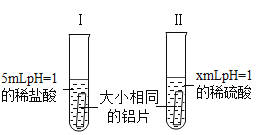
(1)实验中X的数值为_______________,写出铝与稀盐酸反应的化学方程式_______________。
(2) [提出问题]什么原因影响铝和稀盐酸和稀硫酸反应现象不同?
(3)[猜想假设]猜想一:________________对反应起了促进作用;猜想二:稀硫酸中的硫酸根离子对反应起了阻碍作用。
(4)[实验验证]为了验证哪个猜想正确,小明进行了如下实验:向试管II中加入少量____________ (填序号),向试管I中加入少量______________(填序号),做对比实验。
A硫酸铜 B氯化钠 C硫酸钠 D浓盐酸
通过对比实验,观察到_____________________现象,则猜想一成立。
(5) [反思评价]右图是小红将一根铝丝与过量的稀盐酸混合在一密闭容器内反应,利用压强和温度传感器测出的反应变化过程(上面是压强变化曲线、下面是温度变化曲线)。那么,在__________(填“A、 B、C、D”)点时铝与酸反应结束,请你解释压强曲线AB段、BC段、CD段变化原因。
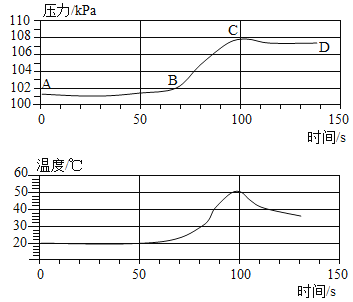
①____________________。
②_____________________。
③_____________________。
【答案】5 ![]() 氯离子 B C 试管II中产生大量气泡 C AB段压强几乎不变是由于稀盐酸先与铝丝表面氧化膜(氧化铝)反应,生成氯化铝和水,没有气体生成 BC段压强快速增大是因为稀盐酸与铝反应生成了氢气,并放出热量 CD段压强逐渐减小是由于反应停止,温度逐渐降低
氯离子 B C 试管II中产生大量气泡 C AB段压强几乎不变是由于稀盐酸先与铝丝表面氧化膜(氧化铝)反应,生成氯化铝和水,没有气体生成 BC段压强快速增大是因为稀盐酸与铝反应生成了氢气,并放出热量 CD段压强逐渐减小是由于反应停止,温度逐渐降低
【解析】
(1)控制单一变量是酸的不同,故实验中X的数值为5,铝与稀盐酸反应生成氯化铝和氢气,反应的化学方程式为![]() 。
。
(3)[猜想假设]:
猜想一:氯离子对反应起了促进作用;猜想二:稀硫酸中的硫酸根离子对反应起了阻碍作用。
(4)[实验验证]:
为了验证哪个猜想正确,向试管II中加入少量氯化钠,向试管I中加入少量硫酸钠,做对比实验,硫酸铜与铝反应、浓盐酸会增加酸的浓度,均不符合题意;
通过对比实验,观察到试管II中产生大量气泡现象,则猜想一成立。
(5) [反思评价]:
在C点之后,密闭容器内压强趋于稳定,故C点时,铝与酸反应结束;
①AB段压强几乎不变是由于稀盐酸先与铝丝表面氧化膜(氧化铝)反应,生成氯化铝和水,没有气体生成。
②BC段压强快速增大是因为稀盐酸与铝反应生成了氢气,并放出热量。
③CD段压强逐渐减小是由于反应停止,温度逐渐降低。

【题目】阅读下面科普短文。
[科普阅读理解]
柠檬酸广泛存在于植物中,如:柠檬、复盆子、葡萄等。因最初从柠檬果的汁中提出,故取名柠檬酸。19世纪末以来,主要用发酵法制取柠檬酸。我国以薯干等为原料,采用的深层发酵技术具有独创性,发酵指数居世界前列。
柠檬酸的化学式为 C6H8O7,又名枸橼酸,白色结晶性粉末,有很强的酸味,易溶于水,水溶液显酸性。0℃时,在100g水中最多可溶解133g。加热至175 ℃时它会分解产生二氧化碳和水,剩余一些白色晶体;与碱、甘油等发生反应。
柠檬酸在食品及卫生等方面具有广泛的用途。

柠檬酸粉
用于杀菌除垢
柠檬酸能与碳酸盐反应,因而能够快速分解附着在热胆内壁、饮水机、发热管、电水壶、蒸蛋器、茶壶等上的水垢。此外,柠檬酸还能杀灭细菌芽孢,具有很强的杀菌作用。某种含柠檬酸的除垢剂配方如图所示。
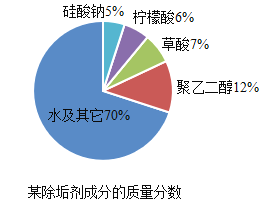
图1某除垢剂成分的质量分数
用于食品工业
柠檬酸有温和爽快的酸味,主要用作清凉饮料、果汁、果酱、水果糖和罐头等的酸性调味剂。同时可改善食品的感官性状,增强食欲和促进体内含磷等营养物质的消化吸收。
某种含柠檬酸的果冻的配料表如下(按100g计):
用料 | 果冻粉 | 白砂糖 | 牡丹花红色素 | 柠檬酸 | 草莓香精 |
用量 | 0.6 g | 17 g | 26 mg | 0.4 g | 0.17 g |
柠檬酸为可食用酸类,无论是用于食品工业还是杀菌除垢,适当剂量的柠檬酸对人体无害。但它可以促进体内钙的排泄和沉积,如长期食用含柠檬酸的食品,有可能导致低钙血症,对身体造成不良的影响。
依据文章内容回答下列问题。
(1)发酵法制取柠檬酸属于___________(填“物理”或“化学”)变化。
(2)柠檬酸中碳、氧元素的质量比为________。
(3)图1所示除垢剂中,柠檬酸所占的质量分数为_________。
(4)上述500g果冻中,含柠檬酸的质量是_____________g。
(5)下列说法正确的是___________(填字母序号)。
A、0℃时,柠檬酸在水中的溶解度是133g
B、只有从柠檬果中提取的柠檬酸,才能安全地食用
C、柠檬酸广泛应用于食品、卫生等领域
D、柠檬口味清爽,食用时多多益善
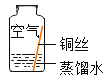
【题目】“五一”假期,聪聪同学和家入到故宫去参观,发现故宫内许多铜制品表面有一层绿色物质。绿色物质是什么?它是怎样形成的?化学活动课上,同学们设计实验对这种绿色物质进行了如下探究活动。
[查阅资料]
①铜在空气易生成铜锈,它为绿色,其主要成分是Cu2(OH)2CO3;
②白色的硫酸铜粉末遇水能变为蓝色。
探究活动一:验证铜锈的组成。
[进行实验1]
同学们设计了如图所示装置并进行实验。
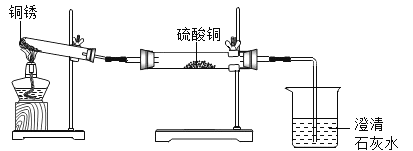
实验操作 | 实验现象 | 实验结论 |
①按上图组装仪器,装入药品。 ②加热铜锈,直至不再有气体产生。 | 绿色固体变为黑色,硫酸铜粉末变为蓝色,烧杯中液体变浑浊 | 加热铜锈生成的物质有CuO、_____,烧杯中发生反应的化学方程式为___________ |
③冷却后,向试管中黑色固体加入适量稀硫酸。 | 黑色固体溶解,溶液变为蓝色 |
探究活动二:探究铜生锈的条件。
[进行实验2]
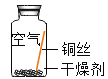
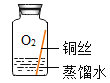
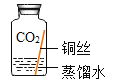
同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显。
序号 | 实验内容 | 实验现象与结论 |
实验1 |
| 在干燥环境中,铜不生锈 |
实验2 |
| 铜仅与氧气和水接触,不生锈 |
实验3 |
| 铜仅与二氧化碳和水接触,不生锈 |
实验4 |
| 铜生锈,它生锈的条件是___________________ |
/span>
[反思与拓展]
(1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其目的是__________________。
(2)如果要除去铜制品表面的铜锈,可以用稀盐酸浸泡,写出反应的化学方程式___________________。
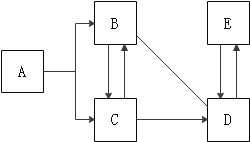
【题目】甲、乙、丙三种物质的转化关系如下图所示(“→”表示反应能一步实现, 部分反应物、生成物和反应条件均已略去),下列选项不能实现图示转化的是
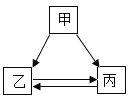
甲 | 乙 | 丙 | |
A | C | CO | CO2 |
B | Na2CO3 | CO2 | CaCO3 |
C | H2SO4 | CuSO4 | Cu(OH)2 |
D | H2O2 | H2O | O2 |
A.AB.BC.CD.D
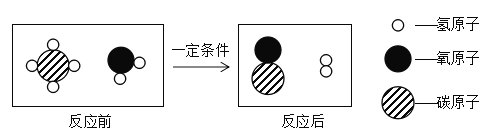
【题目】化学语言是学习化学的重要工具。
(1) 完成下列化学反应的符号表达式:
化学反应 | 符号表达式 |
红磷在氧气中燃烧 | ①__________________ |
木炭在氧气中燃烧 | ②_____________ |
(2)填写化学符号或化学符号表示的含义:
内容 | ③ | ④ | ⑤ | |
化学符号 | 2Fe | ____ | ______ |
|
表示含义 | ______ | 1个钠离子 | 1个氯离子 | 最外层电子数为____,属于____元素(填“金属”或“非金属”)。 |