题目内容
【题目】下表是氯化钾和硝酸钾在不同温度下的溶解度。根据表中数据,请回答下列问题:
温度/°C | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 | |
(1)在所示的坐标纸上绘制出氯化钾的溶解度曲线______________。
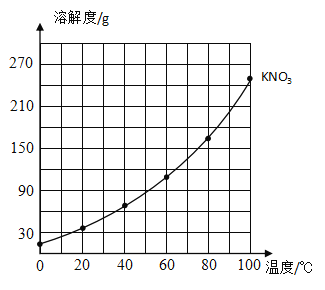
(2)比较两种物质的溶解度曲线,溶解度受温度影响变化较小的是______________,温度大约在___________°C时,两种物质的溶解度大小相等。
(3)60°C时,105g的KNO3饱和溶液中含有的溶质的质量为____________。
(4)40°C时,向烧杯中加入50g水和25gKCl固体,充分溶解后得到的溶液是_____________(填“饱和”或“不饱和”)溶液,其溶质质量分数为_____________(精确到0.1% )。
(5)若KNO3中混有少量的KCl ,提纯KNO3的方法是_____________。
【答案】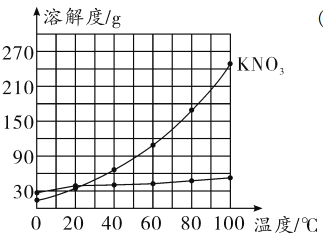 氯化钾 22(其他合理答案均可) 55 g 饱和 28.6% 降温结晶(或冷却热饱和溶液)
氯化钾 22(其他合理答案均可) 55 g 饱和 28.6% 降温结晶(或冷却热饱和溶液)
【解析】
(1)根据表中的数据,在坐标系中找出六个点,然后用平滑的曲线将六个点顺次连接起来,即得到氯化钾的溶解度曲线;
(2)氯化钾的溶解度曲线较硝酸钾的平缓,说明氯化钾的溶解度受温度影响较小,根据曲线可知,大约在22°C时氯化钾和硝酸钾的溶解度相等;
(3)60°C时硝酸钾的溶解度为110g,即210g硝酸钾的饱和溶液中含有的溶质质量为110g,则105g的硝酸钾饱和溶液中含有的溶质的质量为55 g;
(4)40 °C时氯化钾的溶解度为40.0 g,所以该温度下将50g水和25 g氯化钾放入烧杯中充分溶解,所得溶液为饱和溶液,其溶质质量分数为![]() ;
;
(5)硝酸钾和氯化钾的溶解度都随温度升高而增大,但硝酸钾的溶解度受温度影响变化较大,氯化钾的溶解度受温度影响变化不大,所以若硝酸钾中混有少量氯化钾,可通过降温结晶或冷却热饱和溶液的方法提纯硝酸钾。