题目内容
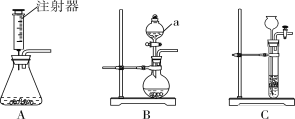
【题目】(11分)(1)实验室用石灰石和稀盐酸制取CO2的原理是 (写化学方程式),可选用下列装置 (填序号)制CO2。设计B装置时使用仪器a的目的是 。
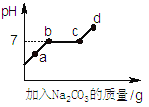
(2)在反应装置的残液中加入Na2CO3溶液,溶液PH变化如图所示(提示:氯化钙溶液呈中性):a点时,溶液中的溶质的化学式是 。bc段溶液pH一直为7的理由是 。滴入Na2CO3溶液的过程中观察到的现象依次是 。
【答案】(1)CaCO3 +CaCl2==CaCl2+H2O+CO2↑
A.B.C (2分,答对2个给1分,只答1个不给分)
通过加入液体的流速来控制反应的速度(1分,合理即可)
(2)CaCl2、HCl、NaCl;(共2分,答对两个给1分,只答一个不给分)
在BC段发生的是CaCl2与Na2CO3的反应,CaCl2呈中性,与滴入的Na2CO3反应生成的NaCl溶液也呈中性,所以在BC段PH值为7(2分)
有气泡产生、有白色沉淀产生(2分,答到1个现象给1分)
【解析】
试题分析:(1)实验室用石灰石和稀盐酸制取CO2时反应的化学方程式原理为CaCO3+2HCl==CaCl2+H2O+CO2↑。制取时采用了固体和液体反应生成气体,所以选用的制取装置为:ABC。B装置中仪器a为分液漏斗,实验中可通过分液漏斗来控制通过加入液体的流速来控制反应的速度的目的。
(2)根据图示可知:残液的PH小于7,即残液中稀盐酸过量;所以b点前的线段为碳酸钠和盐酸反应;bc段表示碳酸钠和氯化钙反应;c点后的线段表示加入的碳酸钠过量;因此a点时,溶液中的溶质的化学式是CaCl2、HCl、NaCl(碳酸钠和盐酸反应生成)。而在BC段发生的是CaCl2与Na2CO3的反应,CaCl2呈中性,与滴入的Na2CO3反应生成的NaCl溶液也呈中性,所以在BC段PH值为7。滴入Na2CO3溶液的过程中,与盐酸反应观察到的现象为有气泡产生;与氯化钙反应可生成碳酸钙沉淀,可观察到白色沉淀产生。

 快捷英语周周练系列答案
快捷英语周周练系列答案