题目内容
【题目】人类文明的发展和社会的进步同金属材料关系十分密切,其中钢铁是基本的结构材料,称为“工业的骨骼”。
(1)自行车的有些部件是由钢铁制成的。钢铁制品被腐蚀的原因,是其与_____接触引起的,为防止自行车链条生锈可采取的措施是_____。
(2)金属锂是密度最小的金属,用于原子反应堆、制轻合金及电池等。锂(Li)的原子结构示意如图1所示,它的化学性质与钠相似,原因是_____。请写出锂与稀硫酸反应的化学方程式:_____。
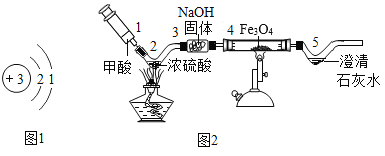
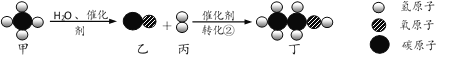
(3)同学们利用自制仪器模拟工业炼铁实验,用图2所示微型实验装置制取CO,然后用CO还原Fe3O4并检验气体产物。已知甲酸(HCOOH)具有挥发性,在热的浓硫酸中分解生成一氧化碳和水。
①位置4发生的化学方程式是_____。
②氢氧化钠固体的作用是什么?_____。
③本实验存在明显缺陷,请给出优化建议_____(写出一点即可)。
(4)工业上可利用铝和氧化铁在高温下发生置换反应制得铁来焊接钢轨。若用足量铝与40kg氧化铁反应,理论上可制得铁的质量是多少_____?
【答案】氧气和水蒸气 涂润滑油 最外层电子数相等 2Li+H2SO4═Li2SO4+H2↑ Fe3O4+4CO![]() 3Fe+4CO2 除去甲酸气体和水 在装置的末端添加一个点燃的酒精灯(或系一个气球) 28kg
3Fe+4CO2 除去甲酸气体和水 在装置的末端添加一个点燃的酒精灯(或系一个气球) 28kg
【解析】
四氧化三铁和一氧化碳在高温下生成铁和二氧化碳,铁生锈是铁和氧气和水共同作用的结果,二氧化碳能使澄清石灰水变浑浊。
(1)钢铁制品被腐蚀的原因,是其与氧气和水蒸气接触引起的。为防止自行车链条生锈,由于链条长期处于摩擦状态,所以不能用刷漆,而只能涂润滑油。
(2)锂(Li)的原子最外层有一个电子,所以,它的化学性质与钠相似,原因是最外层电子数相等。 锂与稀硫酸反应生成硫酸锂和氢气,反应的化学方程式为![]() 。
。
(3)
①位置4是四氧化三铁和一氧化碳在高温下生成铁和二氧化碳,反应的化学方程式为

②氢氧化钠固体具有碱性和吸水性,所以作用是除去甲酸气体和水。
③本实验存在明显缺陷,是由于过程用到一氧化碳,而一氧化碳有毒,所以在装置的末端添加一个点燃的酒精灯(或系一个气球)。
(4)设可制得铁的质量为x
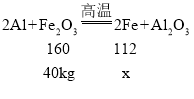
![]()
![]()
答:可制得铁的质量为28kg。

 名校课堂系列答案
名校课堂系列答案【题目】在宏观、微观和符号之间建立联系是化学学科的特点.现有A、B、C、D四种物质,其微观示意图见如表.
物 质 | A | B | C | D |
|
微观示意图 |
|
|
|
|
(1)上述物质中属于单质的是_____(填物质序号);常温下属于液体的是_____(填写化学式),日常生活中可做燃料的是_____(填物质的序号);
(2)一个C分子是由_____构成的;
(3)写出反应A+D→B+C的化学方程式:_____.
【题目】某品牌矿泉水的标签上标明的矿泉水主要成分如表所示,请根据本表回答下列问题。
水质主要成分(mg/L) | |
偏硅酸(H2SiO3) 28.9﹣﹣42.9 碳酸氢根 (HCO3﹣) 173﹣﹣205 镁(Mg2+) 2.5﹣﹣7.5 | 锶(Sr) 0.01﹣﹣0.32 钙 5﹣﹣45 PH 7.8±0.5 |
(1)钙离子的化学符号是_____。
(2)偏硅酸(H2SiO3)中硅元素的化合价为_____。
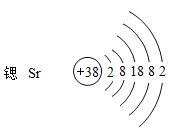
(3)根据锶原子结构示意图,写出氯化锶的化学式_____。