题目内容
【题目】水是人类宝贵的自然资源,我们应该了解有关水的知识。
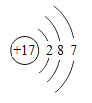
(1)有一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气和氯气(Cl2),该反应的化学方程式为_____。
(2)溶液在生产和生活中有着广泛的应用。某同学配制溶液时,在用量筒量取水的过程中俯视读数,这样配制得到的溶液的溶质质量分数会_____(填“偏大”“偏小”或“无影响”)。
(3)A1与NaOH溶液反应会生成NaA1O2和H2,该反应的化学方程式为_____;已知化学反应前后元素化合价发生改变的属于氧化还原反应,反应物中,元素化合价升高被氧化是还原剂,化合价降低被还原是氧化剂,则该反应中H2O是_____(填氧化剂,还原剂)。
【答案】2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑ 偏大 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ 氧化剂
2NaOH+H2↑+Cl2↑ 偏大 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ 氧化剂
【解析】
(1)氯化钠和水在通电条件下反应生成氢氧化钠、氢气和氯气(Cl2),化学方程式是:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;故填:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;故填:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)某同学配制溶液时,在用量筒量取水的过程中俯视读数,这样量取的水偏少,使配制得到的溶液的溶质质量分数会偏大。故填:偏大
(3)A1与NaOH溶液反应会生成NaA1O2和H2,该反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;在这个反应中,氢元素的化合价由+1价变为0价,化合价降低,是氧化剂。故填:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;氧化剂

 高中必刷题系列答案
高中必刷题系列答案【题目】下面是同学们测定黄铜(铜锌合金)中铜的质量分数的过程。
(1)小华同学取10g黄铜,加入足量的稀硫酸,共收集到气体0.2g,则黄铜中铜的质量分数是多少?____________________(写出计算过程)
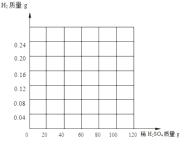
(2)小婷同学另取10g黄铜于烧杯中,向烧杯中加入稀硫酸,测得加入的稀硫酸质量和烧杯中剩余物的质量如下表:
加入稀硫酸的质量/g | 30 | 60 | 90 | 120 |
烧杯中剩余物的质量/g | 39.94 | m | 99.82 | 129.8 |
①表中m=____________,从表中的数据分析,当小婷同学加入_________g稀硫酸时,烧杯中刚好没有气泡产生。
②请在下图画出10g黄铜加入稀硫酸与生成氢气的质量的图像____________________。
【题目】某化学兴趣小组在学习盐的知识时,发现碳酸钠和碳酸钙的组成很相似,他们想知道碳酸钠与稀盐酸反应是否也生成二氧化碳,于是做了如图所示实验.
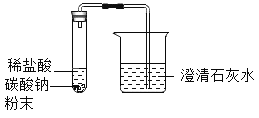
(1)当观察到试管中有气泡产生,烧杯中出现_____现象时,由此可以得出结论:碳酸钠与稀盐酸反应也生成二氧化碳,烧杯中发生反应的化学方程式为_____。
(2)实验结束后,同学们将试管中的物质倒入烧杯中,发现烧杯中的白色沉淀明显增加,于是他们将烧杯内的物质进行过滤,对所得滤液中的溶质进行了探究。
(问题)滤液中溶质的成分有哪些?
(猜想)甲的猜想:滤液中的溶质是NaCl、NaOH
乙的猜想:滤液中的溶质是NaCl、NaOH、Na2CO3
丙的猜想:滤液中的溶质是NaCl、NaOH、_____。
(实验)
实验操作 | 实验现象 | 实验结论 |
取少量滤液于试管中,通入二氧化碳气体 | _____ | 丙的猜想不成立 |
另取少量滤液于试管中,加入适量的_____ | _____ | 甲的猜想不成立 乙的猜想成立 |
(拓展)乙想进一步验证溶质中的氢氧化钠,他的实验方案是:_____,(要求写出药品名称、操作步骤、实验现象)。