题目内容
【题目】元素周期表是化学学习的重要工具,下图是元素周期表的一部分,请认真观察分析并回答问题:
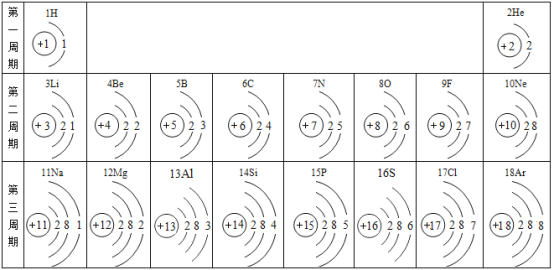
(1)元素周期表中的各种元素的本质区别是_____;决定元素化学性质的是_____
(2)决定元素所在的周期数的是_____第二周期元素的原子核外电子排布的规律是_____。
(3)F、Cl、S三种非金属元素的原子得电子能力逐渐增强,根据这三种非金属元素的原子结构推测:非金属元素的原子得电子能力的强弱主要与_____有关。
(4)水(H2O)、双氧水(H2O2)、重水(D2O,“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质所含的元素共有_____种,从化学性质的角度看,_____与水的化学性质有较大的差异。
(5)原子通过得失电子后可形成稳定粒子。核外有10个电子的粒子有:
①阳离子:_____;
②阴离子:_____;
③中性粒子:_____。
【答案】质子数(或核电荷数) 原子的最外层电子数 原子核外的电子层数 都有两个电子层,第一层都是2个电子,最外层电子数由1依次递增至8(合理即可) 外层电子数或电子层数或原子半径 两 双氧水(或H2O2) Na+、Mg2+、Al3+、NH4+ F-、O2-、OH- Ne、H2O、NH3、CH4
【解析】
(1)元素周期表中的各种元素的本质区别是质子数不同,决定元素化学性质的是最外层电子数,故填:质子数(或核电荷数);原子的最外层电子数。
(2)元素周期数等于核外电子层数,故决定元素所在的周期数的是原子核外电子层数,由表格可知,第二周期元素的原子核外电子排布的规律是都有两个电子层,第一层都是2个电子,最外层电子数由1依次递增至8,故填:原子核外的电子层数;都有两个电子层,第一层都是2个电子,最外层电子数由1依次递增至8(合理即可)。
(3)F、Cl、S三种非金属元素的原子得电子能力逐渐增强,根据这三种非金属元素的原子结构示意图推测:非金属元素的原子得电子能力的强弱主要与外层电子数或电子层数或原子半径有关,故填:外层电子数或电子层数或原子半径。
(4)水(H2O)、双氧水(H2O2)、重水(D2O),“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质都是由氢、氧元素组成,所含的元素共有两种,从结构看一个双氧水分子由两个氢原子和两个氧原子构成,一个水分子由一个氧原子两个氢原子构成,结构差异较大,结构相差较大化学性质差异较大,双氧水与水的化学性质有较大的差异,故填:两;双氧水(或H2O2)。
(5)原子通过得失电子后可形成稳定粒子。核外有10个电子的阳离子有:Na+、Mg2+、Al3+、NH4+;核外有10个电子的阴离子有:F-、O2-、OH-;核外有10个电子的中性粒子有:Ne、H2O、NH3、CH4(合理即可),故填:Na+、Mg2+、Al3+、NH4+;F-、O2-、OH-;Ne、H2O、NH3、CH4。

 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】碳酸钠用途非常广泛,是工业生产中重要的化工原料.在1921年我国科学家侯德榜创造了一种著名的纯碱生产方法﹣﹣“联合制碱法”.“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O═NH4HCO3 该反应属于 反应基本反应类型.
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如图1:
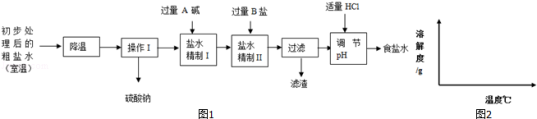
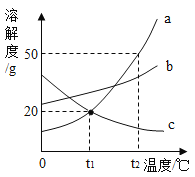
①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图2)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.
②“精制I”操作中,加入过量含钙元素的碱的化学式是 .
其反应化学方程示为 .
③“精制II”操作中,加入B盐的有关反应方程式为 .
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
实验操作 | 实验现象 | 实验结论 |
⑤查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl在30℃时的溶解度如下表所示:
温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
请根据溶解度表所提供的信息,写出“联合制碱法”中的第二步属于复分解反应的化学方程式: .
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑