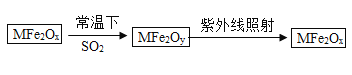
题目内容
【题目】某粗盐样品中含有杂质硫酸钠、氯化钙。小林设计了以下提纯方案:

(1)试剂b的化学式是__
(2)操作过程中加适量稀盐酸时,可能发生的反应的化学方程式是_____
(3)若一次过滤后发现滤液仍浑浊,且滤纸未破损,需接着进行的操作是_
【答案】Na2CO3 ![]() 再过滤一次
再过滤一次
【解析】
由题意可知,粗盐样品中含有杂质硫酸钠、氯化钙,通过加入试剂a为氯化钡可以将硫酸钠转化为硫酸钡沉淀除去,再加入碳酸钠将氯化钙、氯化钡转化为沉淀碳酸钡、碳酸钙除去,过量的碳酸钠通过加入适量的稀盐酸除去,最后通过蒸发得到精盐晶体。
由分析可知(1)若试剂a为氯化钡,试剂b的化学式为:Na2CO3;
(2)盐酸和碳酸钠反应生成氯化钠、二氧化碳和水,反应的化学方程式是![]() ;
;
(3)若一次过滤后发现滤液仍浑浊,且滤纸未破损,需接着进行的操作是再过滤一次。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根据如表回答问题
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 (g/100水) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)20℃时,溶解度最大的物质是_____.
(2)60℃时,100g水中最多溶解NaCl_____g.
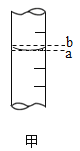
(3)量筒的局部示意图如图甲所示,量取时应沿_____(选填“a”或“b”)视线进行读数.
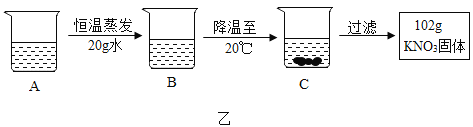
(4)A是80℃含有120g水的KNO3溶液.经过图乙操作,得到102gKNO3固体.
①A溶液为_____(选填“饱和”或“不饱和”)溶液;
②对以上过程的分析,正确的是_____(选填字母).
a A到B的过程中,溶液中溶质的质量没有改变
b B中溶质与溶剂的质量比为169:100
c A溶液的质量等于222g
d 开始析出KNO3固体的温度在60℃至80℃之间
【题目】某校化学研究性学习小组探究气体制取的实验原理与方法.
(1)甲同学将课本的基础知识进行整理如图,请你帮助他完成相关内容.

制取气体 | 所需要品 | 装置连接顺序 | 反应的化学方程式 |
二氧化碳(干燥) | 大理石和稀盐酸 | ______________ | ______________________________ |
(2)乙同学设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.当打开K1、关闭K2时,利用I、Ⅱ装置可直接进行的实验是______________(填序号).
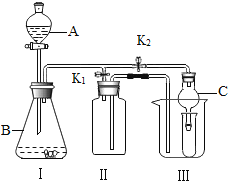
①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)丙同学认为在不改变I、Ⅱ、Ⅲ装置的仪器及
位置的前提下,该装置可用于过氧化钠(Na2O2)与水反应制取氧气,另一产物为氢氧化钠,则该反应的化学方程式为:______________________________;她的改进措施是_______________________________________________________.
(4)丁同学打开K2、关闭K1,利用I、Ⅲ装置来验证生成的二氧化碳中含有水蒸气,此时C中盛放的物质是_______________,可以观察到的现象是________________________________________.
(5)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应)作如下回收处理:
①通过以下四步实验操作回收二氧化锰.正确操作的先后顺序是____________(填写选项序号).
a.烘干b.溶解c.过滤d.洗涤
②用所得氯化钾晶体配制50g质量分数为5%的氯化钾溶液,需要氯化钾的质量为_______g.
③过滤、蒸发时都需用到的仪器是__________(填序号).
A.酒精灯B.烧杯C.玻璃棒D.漏斗E.量筒
(6)小明用6.5g可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成0.2g氢气,则此锌粉中一定含有的金属杂质是________________.