题目内容
【题目】碳酸钠用途非常广泛,是工业生产中重要的化工原料.在1921年我国科学家侯德榜创造了一种著名的纯碱生产方法﹣﹣“联合制碱法”.“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O═NH4HCO3 该反应属于 反应基本反应类型.
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如图1:
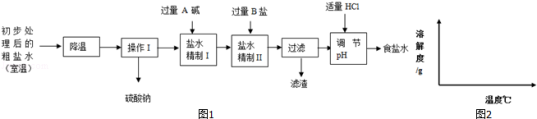
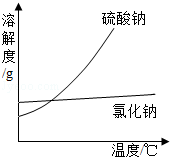
①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图2)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.
②“精制I”操作中,加入过量含钙元素的碱的化学式是 .
其反应化学方程示为 .
③“精制II”操作中,加入B盐的有关反应方程式为 .
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
实验操作 | 实验现象 | 实验结论 |
⑤查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl在30℃时的溶解度如下表所示:
温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
请根据溶解度表所提供的信息,写出“联合制碱法”中的第二步属于复分解反应的化学方程式: .
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
【答案】(1)化合;(2)①如图
②Ca(OH)2、Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2
③CaCl2+Na2CO3=2NaCl+CaCO3↓;Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
④NH4HCO3+NaCl=NaHCO3↓+NH4Cl
方法一
实验操作 | 实验现象 | 实验结论 |
取“精制II”过滤后的滤液少许于试管中,滴入氯化钙溶液,观察. | 产生白色沉淀 | 碳酸钠已过量 |
方法二
实验操作 | 实验现象 | 实验结论 |
取“精制II”过滤后的滤液少许于试管中,滴入稀盐酸,观察. | 产生气泡 | 碳酸钠已过量 |
【解析】解(1)NH3+CO2+H2O=NH4HCO3的反应为多变一的化合反应,
(2)①硫酸钠的溶解度随温度变化明显而氯化钠的溶解度受温度变化不明显

②加入碱是使镁离子沉淀,故含钙的碱为氢氧化钙,与氯化镁反应生氢氧化镁和氯化钙,所以本题答案为:Ca(OH)2;Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2,
③要除去氯化钙可以加入含碳酸根的盐如碳酸钠,加入的碳酸钠还能除去过量的氢氧化钙,所以本题答案为:CaCl2+Na2CO3=2NaCl+CaCO3↓;Ca(OH)2+Na2CO3=2NaOH+CaCO3↓,
④碳酸钠属于碳酸盐,能与酸反应生成二氧化碳气体,所以本题答案为:
方法一
实验操作 | 实验现象 | 实验结论 |
取“精制II”过滤后的滤液少许于试管中,滴入氯化钙溶液,观察. | 产生白色沉淀 | 碳酸钠已过量 |
方法二
实验操作 | 实验现象 | 实验结论 |
取“精制II”过滤后的滤液少许于试管中,滴入稀盐酸,观察. | 产生气泡 | 碳酸钠已过量 |
⑤用食盐与NH4HCO3反应,能生成碳酸氢钠和氯化铵,所以本题答案为:NH4HCO3+NaCl=NaHCO3↓+NH4Cl.
