题目内容
【题目】空气中氧气含量测定再认识。
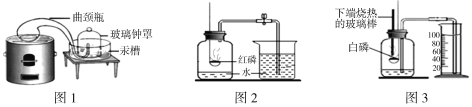
【你知道吗】通过实验(图1)测定了空气组成的科学家是 。
A.门捷列夫 B.达尔文 C.拉瓦锡 D.牛顿
【实验回顾】实验室常用图2所示的方法测定空气中氧气的含量,写出红磷燃烧的化学方程式 。为保证测定结果,实验中所取红磷必须 。
同学们发现利用图2装置进行实验时,在集气瓶外点燃红磷,一方面会造成空气污染,另一方面伸进集气瓶速度慢了会影响测定结果。他们查阅资料发现白磷40℃即可燃烧,燃烧产物与红磷相同,于是改进装置(图3)重新探究。
【实验探究】先在容积为200.0mL的集气瓶里装进50.0mL的水,再在量筒内装入100.0 mL的水,然后按图连好仪器,按下热的玻璃棒,白磷立即被点燃。
(1)集气瓶里预先装进的水,在实验过程中除了能够加快集气瓶冷却,还起到 作用。(写出一种即可)
(2)如果白磷停止燃烧时立即记录量筒内剩余水的体积,则会导致测定结果
(填“偏大”、“偏小”或“不变”)。
(3)如果实验结束时量筒内剩余水的体积是73.0 mL,则测得的空气中氧气体积分数为 。(用百分数表示)
【拓展延伸】图4所示装置可用于测定空气中氧气的含量,其中与集气瓶相连的压强传感器等电子设备能将集气瓶内气体压强精确地记录并保存下来。图5、图6是用该装置测得的红磷和木炭分别在集气瓶中燃烧的压强﹣时间关系图(该装置气密性良好,p0是集气瓶内初始气压,p和p′分别是反应结束后恢复到室温时集气瓶内的气压)。
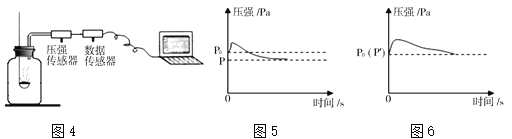
(1)写出木炭燃烧的化学方程式 。该实验中能否利用木炭燃烧测定空气中氧气含量,并说明理由 。
(2)从微观角度解释图5中反应开始时集气瓶中压强瞬间变大的原因是 。
【交流反思】小明提出能否用铁丝代替上述实验中的红磷测定空气中氧气含量,同学们一致反对,理由是铁丝在空气中不能燃烧。写出铁丝在氧气中燃烧的化学方
【答案】【你知道吗】C
【实验回顾】4P + 5O2![]() 2P2O5 过量(或足量)
2P2O5 过量(或足量)
【实验探究】(1)液封或缓冲压强或吸收白烟(合理即可)(2)偏小 (3)18%
【拓展延伸】(1)C + O2![]() CO2
CO2
不能,因为木炭燃烧生成的二氧化碳也是气体,瓶中气压不变。
(2)燃烧放热,温度升高,气体分子运动加快
【交流反思】3Fe + 2O2![]() Fe3O4
Fe3O4
【解析】
试题分析:(1)法国的拉瓦锡最早利用天平作为工具,用定量的方法测定并得出空气的组成,
(2)红磷在空气中燃烧,其实质是红磷和空气中的氧气在点燃的条件下生成五氧化二磷,其反应的化学方程式为4P + 5O2![]() 2P2O5 ;为保证测定结果,实验中所取红磷必须过量。
2P2O5 ;为保证测定结果,实验中所取红磷必须过量。
(3)在集气瓶里预先装进的50mL水,在实验过程中可以加快集气瓶冷却、液封导气管末端以防气体逸出并且能够缓冲集气瓶内气压的骤然升高;如果白磷停止燃烧时立即记录量筒内剩余水的体积,则会导致测定结果偏小;集气瓶内空气的体积是(200﹣50)mL=150ml,进入水的体积是(100-73)mL,即氧气的体积是27mL,因此氧气的体积分数27ml/150ml=18%
(4)C + O2![]() CO2 ;不能,因为木炭燃烧生成的二氧化碳也是气体,瓶中气压不变。
CO2 ;不能,因为木炭燃烧生成的二氧化碳也是气体,瓶中气压不变。
(2)燃烧放热,温度升高,气体分子运动加快

【题目】下表是部分农作物生长对土壤pH的要求。如果某地区经常降酸雨,则该地区最不适合种植的农作物是 ( )
农作物 | 大豆 | 茶 | 玉米 | 马铃薯 |
pH | 6.0~7.0 | 5.0~5.5 | 7.0~8.1 | 4.8~5.5 |
A. 大豆 B. 茶 C. 玉米 D. 马铃薯