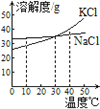
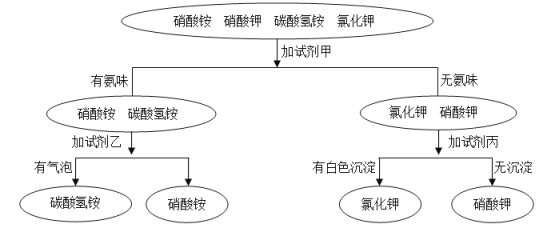
题目内容
【题目】根据下列实验回答有关问题:
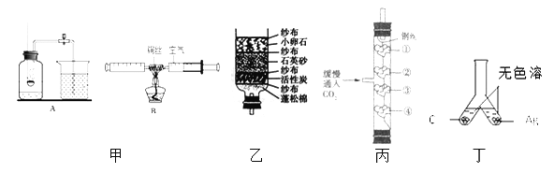
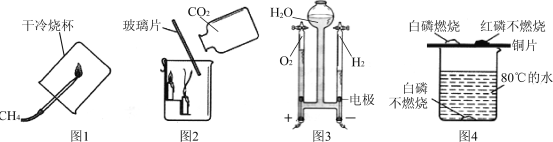
(1)甲中A、B是空气中氧气含量测定的两个实验,实验时发现实验B测量更准确,原因是_______________________________________________。
(2)乙是净化水的简易装置,该装置净化水的方法是过滤和____________。
(3)丙中①④为用紫色石蕊溶液润湿的棉球,②③为浸过紫色石蕊溶液的干燥棉球,缓慢通入CO2后,最先变红色的是_________(填编号,下同),不变红色的是_______________。
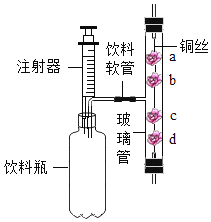
(4)丁是探究Cu和Ag的金属活动顺序,无色溶液可能是_________(填编号)。
①稀H2SO4 ②FeSO4溶液 ③Cu(NO3)2溶液 ④AgNO3溶液
【答案】 B装置始终是密封装置 吸附 ④ ②③ ④
【解析】(1)实验B气密性更好,在实验过程中不需要打开塞子,装置始终密封;
(2)简易净水器中小卵石、石英沙和膨松棉的作用是过滤,除去一些不溶性杂质;活性炭具有吸附性,能起吸附杂质、色素的作用;
(3)将二氧化碳缓慢通入竖直放置的玻璃管中,①④为用紫色石蕊溶液润湿的棉球,②③为用石蕊溶液染成紫色的干燥棉球。二氧化碳不能使石蕊变色,用石蕊溶液染成紫色的干燥棉球②③都不变色;二氧化碳和水发生了化学反应生成碳酸,碳酸显酸性,能使石蕊试液变红色,故用紫色石蕊溶液润湿的棉球①④都变红;二氧化碳的密度比空气的大,则④比①先变红;
(4)①铜和银的活动性都位于H后,所以铜和银都不与稀H2SO4反应,无法比较二者的活动性,错误; ②铜和银的活动性都位于Fe后,所以铜和银都不与FeSO4溶液反应,无法比较二者的活动性,错误;③Cu(NO3)2不与银反应,说明铜的活动性比银强,但是硝酸铜溶液是蓝色的,错误;④铜都比银强,都能与硝酸银发生置换反应,说明铜的活动性比银强,正确。故填④。

【题目】为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,某同学称取m g的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀盐酸质量(g) | 10 | 10 | 10 | 10 |
剩余固体的质量(g) | 9.10 | 8.45 | 7.80 | 7.80 |
(1)通过计算确定m的值为__________。
(2)铜锌合金中铜的质量分数为多少_________?(写出(1)、(2)计算过程)
(3)求所用稀盐酸中溶质的质量分数__________。(写出计算过程)
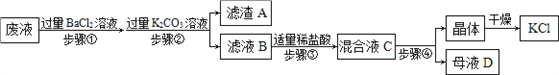
【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
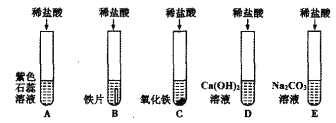
(1)A试管中的实验现象为______________,C试管中所发生反应的化学方程式为____________。
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(作出猜想)猜想:NaCl
猜想二:NaCl和CaCl2
猜想三:______________
猜想四:NaCl、Ca(OH)2和HCl
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液。 | _________ | 猜想二不成立 |
取少量滤液于试管中, 滴加_______(填名称)。 | _________ | 猜想三成立 |
(迁移拓展)稀盐酸、稀硫酸有一些相似的化学性质,是因为在不同的酸溶液中都含有__________。