题目内容
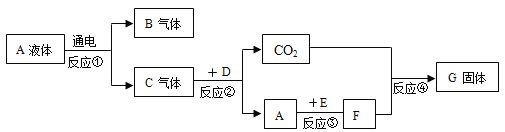
【题目】某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分 Fe2O3),实验方案如下图所示。
(资料)Ⅰ.含有铁元素的碱均不溶于水。
Ⅱ.不溶性的碱加热条件下,可生成价态相同的氧化物和水。
Ⅲ.氢氧化亚铁可在空气中氧化成氢氧化铁。
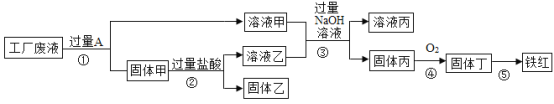
(1)步骤①②③中的相同操作是_______________。
(2)步骤③发生的反应属于复分解反应,反应的化学方程式为__________。
(3)检验 A 是否过量的方法为______________________。
【答案】过滤 FeCl2+2NaOH=Fe(OH)2↓+2NaCl,NaOH+HCl=NaCl+H2O 取固体甲加入稀盐酸,若有气泡产生则铁过量,反之,不过量
【解析】
(1)步骤①②③中都是将不溶固体与液体分离,操作是过滤;
(2)废液中含有氯化钠、氯化铜和氯化亚铁,要从废液中回收铜并得到铁红,所以过量的A是铁,铁和氯化铜反应生成氯化亚铁和铜,固体甲是铁和铜、液体甲是氯化铁和氯化钠的混合溶液;溶液乙是盐酸和铁反应生成氯化亚铁;步骤③发生的反应是氯化亚铁和氢氧化钠生成氢氧化亚铁沉淀和氯化钠,及盐酸和氢氧化钠生成氯化钠和水,都属于复分解反应,反应的化学方程式分别为FeCl2+2NaOH=Fe(OH)2↓+2NaCl,NaOH+HCl=NaCl+H2O ;
(3)如果铁过量,则固体甲中有铁,利用铁是活泼金属,能与酸反应生成盐和氢气,检验铁是否过量的方法为:取固体甲加入稀盐酸,若有气泡产生则铁过量,反之,不过量。

 阅读快车系列答案
阅读快车系列答案【题目】马英同学取某地石灰石样品12 g进行测定实验,现将100 g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示。试求:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 1.1 | 2.2 | m | 4.4 | 4.4 |
(1)m的值为_____g。
(2)12 g石灰石样品中碳酸钙的质量为____g。
(3)反应完全后最终溶液中氯化钙的质量分数?(写出计算过程,计算结果精确至0.1%)________
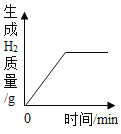
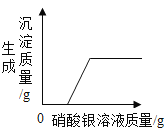
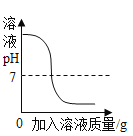
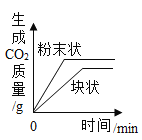
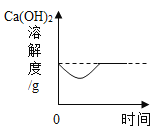
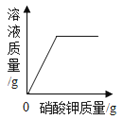
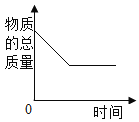
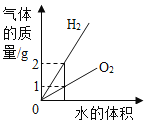
【题目】如图所示图像中,能正确反映对应变化关系的是
A | B | C | D |
|
|
|
|
向饱和石灰水中加入一定量CaO | 一定温下,向不饱和硝酸钾溶液中加入硝酸钾固体 | 一定质量的红磷在密闭容器内燃烧 | 电解水生成氢气和氧气质量 |
A. A B. B C. C D. D