题目内容
【题目】请根据下图回答问题:

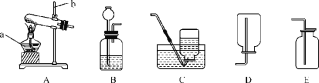
(1)写出下列仪器的名称:A_____,B_____。
(2)用KClO3与MnO2混合制取和收集O2,最好选用上图中的_____(填字母,下同),收集时观察到_____表明O2已集满。上述制取O2反应的化学方程式为_____。
(3)实验室常用硫化亚铁(FeS)固体和稀硫酸溶液,在常温下发生复分解反应制取硫化氢(H2S)气体,其发生装置应选用上图中的_____(加持装置已略去),制取硫化氢气体的化学方程式为_____。
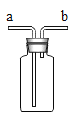
(4)用如图装置可以收集氢气,则气体应从_____(填“a”或“b”)端通入;若气体从a端通入广口瓶干燥氢气,广口瓶应盛装试剂的名称是_____。
(5)兴趣小组在探究CO2性质实验时进行了如图改进,将左侧胶头滴管中的稀硫酸注入装有碳酸钠粉末的小试管中,右侧管内挂的是紫色石蕊试液浸泡过的滤纸条,其中一条是湿润的,一条是干燥的。
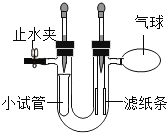
①证明二氧化碳可与水反应的现象是_____。
②将右侧胶头滴管内的药品注入U形管内,观察到气球明显变瘪,则右侧胶头滴管中的药品为_____。
【答案】试管 长颈漏斗 ACDH(漏写不给分) 集气瓶口有气泡冒出 2KClO3![]() 2KCl+3O2↑ ABE(漏写不给分) FeS+H2SO4═H2S↑+FeSO4 b 浓硫酸 干燥的滤纸不变色,湿润的滤纸变红色(漏写不给分) NaOH溶液(合理即可)
2KCl+3O2↑ ABE(漏写不给分) FeS+H2SO4═H2S↑+FeSO4 b 浓硫酸 干燥的滤纸不变色,湿润的滤纸变红色(漏写不给分) NaOH溶液(合理即可)
【解析】
(1)仪器A的名称是试管;仪器B的名称是长颈漏斗;
(2)如果用氯酸钾制氧气就需要加热,氧气不易溶于水,密度大于空气可用排水法或向上排空气法收集,根据题中提供的仪器,用KClO3与MnO2混合制取和收集O2,最好选用上图中的ACDH;收集时观察到集气瓶口有气泡冒出,表明氧气已集满;氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,反应的化学方程式为: 2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(3)实验室常用硫化亚铁(FeS)固体和稀硫酸,在常温下发生复分解反应制取硫化氢(H2S)气体,因此不需要加热,需要的仪器有ABE,硫化亚铁与硫酸反应生成硫化氢气体和硫酸亚铁,反应的化学方程式为:FeS+H2SO4═H2S↑+FeSO4;
(4)氢气的密度比空气小,用如图2装置可以收集氢气,则气体应从b(短)管进入;浓硫酸具有吸水性且不与氢气反应,氢气可以浓硫酸干燥;
(5)图3中,证明二氧化碳可与水反应的现象是:干燥的滤纸不变色,湿润的滤纸变红色;将右侧胶头滴管内的药品注入U形管内,观察到气球明显变瘪,则右侧胶头滴管中的药品为NaOH溶液,二氧化碳被氢氧化钠溶液吸收,因此气球变瘪。

 愉快的寒假南京出版社系列答案
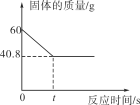
愉快的寒假南京出版社系列答案【题目】某化学兴趣小组使用如图所示装置,对某种锌铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入20.0g合金样品。开始计时,并将电子天平的读数记录在下表中,请回答下列问题:

空烧杯 | 加入硫酸后 | 加入合金后5分钟 | 加入合金后12分钟 | 加入合金后21分钟 | 加入合金后40分钟 | 加入合金后3小时 | |
读数(g) | 28.5 | 169.7 | 189.6 | 189.5 | 189.4 | 189.3 | 189.3 |
(1)合金中锌元素的质量分数为多少?
(2)完全反应后.烧杯中盐的质量为多少克? (计算结果精确至0.1g)
【题目】已知废旧干电池填料中含有二氧化锰、氯化铵和氯化锌等,某化学兴趣小组想回收利用废旧干电池中的二氧化锰和氯化铵,设计了如下流程:

(1)操作1和操作2的名称都是_____,该操作中用到的玻璃仪器除漏斗、烧杯外,还需要_____,其作用是_____。
(2)灼烧滤渣l时,会产生一种使澄清石灰水变浑浊的气体,由此推测滤渣1中除含有MnO2外,还存在的物质是_____。
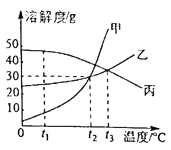
(3)己知滤液1中氯化铵和氯化锌的浓度相近.在某温度下蒸发滤液1时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度_____氯化锌的溶解度(填“<”、“=”或“>”)。
(4)同学们还设计了下列实验探究滤液2中的溶质成分。
(猜想)猜想一:氯化锌 猜想二:_____ 猜想三:氯化锌和氯化铵
(查阅资料)在氯化锌溶液中逐滴滴入稀氨水,先会生成白色沉淀,继续滴加白色沉淀会溶解。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
取少量滤液2,加入到过量氢氧化钠溶液中,并加热 | _____ | 滤液2中含有氯化铵 |
另取少量滤液2,_____ | _____ | 滤液2中含有氯化锌 |
(结论)猜想三成立。