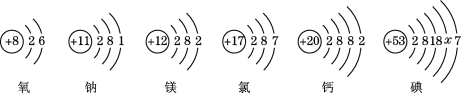
题目内容
【题目】六水合硫酸镍(NiSO4·6H2O)是一种重要的工业原料。该物质为绿色易溶于水的晶体,在280℃时失去结晶水生成黄绿色无水物,当温度更高开始分解,释放出三氧化硫,变成氧化镍。该晶体可有含镍、铜、铁的电镀废渣为原料获得,主要流程如下:
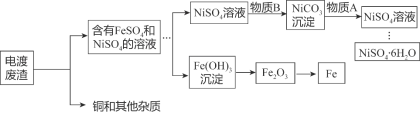
(1)由NiSO4溶液得到六水合硫酸镍晶体最好用加热浓缩,然后再降温结晶而不是蒸发结晶的原因____。
(2)电镀废渣中Fe与物质A发生反应的化学方程式为______________________________,该反应属于__________反应(填基本反应类型)。
(3)NiCO3沉淀转化为NiSO4溶液发生反应的化学方程式为____________________。
(4)该工艺流程还可制得Fe,214gFe(OH)3理论上能得Fe的质量为__________。
【答案】六水合硫酸镍受热易分解 Fe+H2SO4=FeSO4+H2↑ 置换反应 NiCO3+H2SO4=NiSO4+CO2↑+H2O 112g
【解析】
(1)由题意可知,六水合硫酸镍在280℃时失去结晶水生成黄绿色无水物,当温度更高开始分解,释放出三氧化硫,变成氧化镍,故六水合硫酸镍受热易分解,不能用蒸发结晶的方法;
(2)由流程图可知,碳酸镍和A物质反应生成硫酸镍,故A物质为稀硫酸,故铁和稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为Fe+H2SO4=FeSO4+H2↑;该反应属于置换反应;
(3)由流程图可知,碳酸镍和A物质反应生成硫酸镍,故A物质为稀硫酸,其产物还有水和二氧化碳,反应的化学方程式为:NiCO3+H2SO4=NiSO4+CO2↑+H2O;
(4)由元素守恒可知,铁元素的质量不发生变化,故铁元素的质量=214g×![]() ×100%=112g,故理论上能得Fe的质量为112g。
×100%=112g,故理论上能得Fe的质量为112g。

 阅读快车系列答案
阅读快车系列答案