题目内容
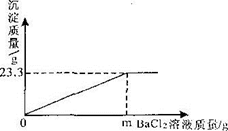
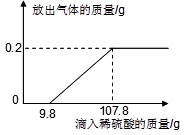
(6分)现有一瓶硫酸溶液,为测定其溶质的质量分数,取该溶液98g于烧杯中,逐渐加入足量的氯化钡溶液,反应中物质间的质最关系如右图所示。请计算:
(1)原硫酸溶液中溶质的质量分数。
(2)若取一定量该硫酸溶液配制509溶质的质量分数为7%的稀硫酸,需加人水的质量是多少?
(1)原硫酸溶液中溶质的质量分数。
(2)若取一定量该硫酸溶液配制509溶质的质量分数为7%的稀硫酸,需加人水的质量是多少?

(1)解:设:98g稀硫酸中含硫酸质量为x。
H2SO4 + BaCl2 = BaSO4↓+ 2HCl
98 233×23.3g …………………… 1分
 x=9.8g ………………………………………………2分
x=9.8g ………………………………………………2分
该硫酸溶液中溶质的质量分数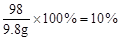 ……………………1分
……………………1分
(2)解:设配制溶质质量分数为7%的硫酸溶液50g,需用溶质质量分数为10%的硫酸溶液的质量是y
50g×7%=y·10% y=35g ……………………………………………1分
需加A水的质量是50g-35g="15g" ……………………………………l分
答:(1)原硫酸溶液中溶质的质量分数为l0%;(2)需加入水的质量是l5g。
H2SO4 + BaCl2 = BaSO4↓+ 2HCl
98 233×23.3g …………………… 1分
 x=9.8g ………………………………………………2分
x=9.8g ………………………………………………2分该硫酸溶液中溶质的质量分数
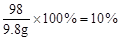 ……………………1分
……………………1分(2)解:设配制溶质质量分数为7%的硫酸溶液50g,需用溶质质量分数为10%的硫酸溶液的质量是y
50g×7%=y·10% y=35g ……………………………………………1分
需加A水的质量是50g-35g="15g" ……………………………………l分
答:(1)原硫酸溶液中溶质的质量分数为l0%;(2)需加入水的质量是l5g。
分析:(1)根据图示可得出恰好反应时生成沉淀质量为23.3g,可根据沉淀的质量,有化学方程式计算出反应的硫酸溶质的质量,最后求出硫酸溶液的质量分数.
(2)根据稀释前后溶质的质量守恒建立等式关系进行解答.
解:根据图示可得出恰好反应时生成沉淀硫酸钡的质量为23.3g
设98g稀硫酸中含硫酸质量为x.
H2SO4+BaCl2=BaSO4↓+2HCl
98 233
x 23.3g
 解之得:x=9.8g
解之得:x=9.8g
该硫酸溶液中溶质的质量分数=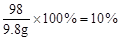
(2)解:设配制溶质质量分数为7%的硫酸溶液50g,需用溶质质量分数为10%的硫酸溶液的质量是y
50g×7%=y?10%
解之得:y=35g
需加入水的质量是50g-35g=15g
答:(1)原硫酸溶液中溶质的质量分数为l0%;(2)需加入水的质量是l5g.
点评:本题主要考查利用化学方程式进行计算的能力,依据溶液稀释的规律.
(2)根据稀释前后溶质的质量守恒建立等式关系进行解答.
解:根据图示可得出恰好反应时生成沉淀硫酸钡的质量为23.3g
设98g稀硫酸中含硫酸质量为x.
H2SO4+BaCl2=BaSO4↓+2HCl
98 233
x 23.3g
 解之得:x=9.8g
解之得:x=9.8g 该硫酸溶液中溶质的质量分数=
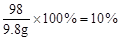
(2)解:设配制溶质质量分数为7%的硫酸溶液50g,需用溶质质量分数为10%的硫酸溶液的质量是y
50g×7%=y?10%
解之得:y=35g
需加入水的质量是50g-35g=15g
答:(1)原硫酸溶液中溶质的质量分数为l0%;(2)需加入水的质量是l5g.
点评:本题主要考查利用化学方程式进行计算的能力,依据溶液稀释的规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 Na2SO4 + H2O + CO2↑)
Na2SO4 + H2O + CO2↑)