题目内容
(6分)取碳酸钠和氯化钠的混合物10g,投入50g溶质质量分数为9.8%的稀硫酸中,恰好完全反应,假设生成的气体全部逸出。计算:
(1)反应中生成二氧化碳气体的质量;
(2)该混合物中碳酸钠的质量分数。

(提示:反应的化学方程式为Na2CO3+ H2SO4 Na2SO4 + H2O + CO2↑)
Na2SO4 + H2O + CO2↑)
(1)反应中生成二氧化碳气体的质量;
(2)该混合物中碳酸钠的质量分数。

(提示:反应的化学方程式为Na2CO3+ H2SO4
 Na2SO4 + H2O + CO2↑)
Na2SO4 + H2O + CO2↑)设反应中生成二氧化碳气体的质量为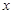 ,样品中的碳酸钠的质量为
,样品中的碳酸钠的质量为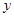 。
。
Na2CO3+H2SO4=Na2SO4+H2O +CO2↑
106 98 44
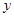 50g×98%
50g×98% 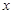
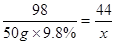
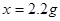
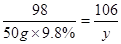
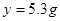
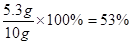
答:生成二氧化碳气体的质量为2.2g,样品中碳酸钠的质量分数为53%。
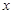 ,样品中的碳酸钠的质量为
,样品中的碳酸钠的质量为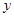 。
。Na2CO3+H2SO4=Na2SO4+H2O +CO2↑
106 98 44
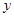 50g×98%
50g×98% 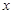
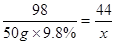
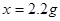
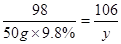
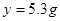
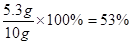
答:生成二氧化碳气体的质量为2.2g,样品中碳酸钠的质量分数为53%。
分析:由题意可知,碳酸钠和硫酸反应生成了硫酸钠、二氧化碳、水,根据化学方程式所表示的质量比,由硫酸溶液中溶质的质量可以求出生成二氧化碳的质量和混合物中碳酸钠的质量;由碳酸钠的质量和混合物的质量,就可以求出混合物中碳酸钠的质量分数.
解:设反应中生成二氧化碳气体的质量为x,样品中的碳酸钠的质量为 y.
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 98 44
y 50g×9.8% x
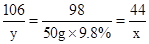
x=2.2g
y=5.3g,
混合物中碳酸钠的质量分数为:
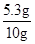 ×100%=53%
×100%=53%
答:生成二氧化碳气体的质量为2.2g,样品中碳酸钠的质量分数为53%.
点评:本题主要考查了根据化学方程式计算,通过练习,培养学生按照化学的特点去进行思维的良好习惯和熟练的计算机能.
解:设反应中生成二氧化碳气体的质量为x,样品中的碳酸钠的质量为 y.
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 98 44
y 50g×9.8% x
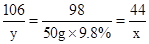
x=2.2g
y=5.3g,
混合物中碳酸钠的质量分数为:
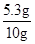 ×100%=53%
×100%=53%答:生成二氧化碳气体的质量为2.2g,样品中碳酸钠的质量分数为53%.
点评:本题主要考查了根据化学方程式计算,通过练习,培养学生按照化学的特点去进行思维的良好习惯和熟练的计算机能.

练习册系列答案
相关题目
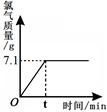
 Cl2↑+ H2↑+ 2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠恰好完全反应时,得到51.2 g溶液,生成氯气的质量与时间的关系如图所示。请计算:
Cl2↑+ H2↑+ 2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠恰好完全反应时,得到51.2 g溶液,生成氯气的质量与时间的关系如图所示。请计算: