题目内容
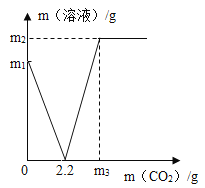
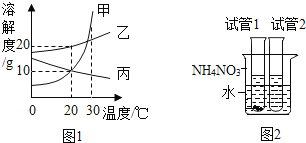
【题目】20℃时,向100g水中不断加入固体甲或改变温度,得到相应的溶液①—③。下列说法不正确的是( )

A.甲的溶解度曲线可用图2中的a表示B.①中溶质与溶剂的质量比为1:5
C.只有②中的溶液为饱和溶液D.①—③中溶液的溶质质量分数③>②>①
【答案】C
【解析】
A、由图1可知40℃时40g甲在100g水中全部溶解,图2中40℃时a溶解度40g,与甲相符,A正确。
B、①中溶质质量20g,溶剂100g,故溶质与溶剂的质量比为1:5,故B正确。
C、图2中40℃时a溶解度40g,故③也为饱和溶液,C错误符合题意。
D、①—③溶液中溶剂质量相等,溶液①20g甲全部溶解溶质20g,溶液②20℃时甲溶解度30g,40g甲只能溶解30g,故溶质30g,溶液③40g甲全部溶解,溶质质量40g,故溶质质量分数③>②>①,正确。
故选C。

 字词句段篇系列答案
字词句段篇系列答案【题目】小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡。为了解其反应过程,他与学习小组的同学进行了如下探究。
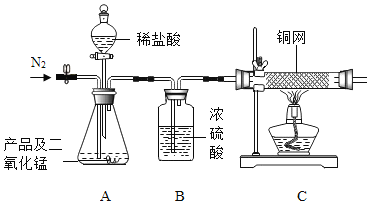
(探究一)小组同学根据所学的化学知识设计并进行了如图所示的实验。
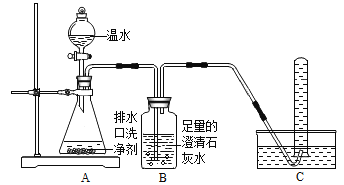
A B C
实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺。由此同学们得出结论:生成的两种气体分别是:______(填化学式)。B中有关反应的化学方程式是_____________________________________。
(探究二)
(1)实验过程:
教师提供了一瓶过碳酸钠(Na2CO4),小组同学进行了如下实验探究:

(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设: 根据以上实验现象,X溶液中一定存在的溶质是________;还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种。
(4)查找资料:
资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;
氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3 + CaCl2 ═ CaCO3↓ + 2NaCl。
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀;碳酸氢钠、碳酸钠与足量的酸反应产物相同。
(5)实验过程:小组同学对溶液X中的溶质进行了如下实验。请将下列实验方案填写完整。
实验操作 | 主要实验现象 | 结论 |
① |
| 证明溶液中有Na2CO3 |
② |
| 证明溶液中无NaHCO3 |
③ |
| 证明溶液中无NaOH |
(6)实验反思:根据资料,NaHCO3溶液能与石灰水反应生成白色沉淀。于是,同学们猜想:碳酸氢钠与氢氧化钠是否可以发生__________________________(写方程式)这样的反应?于是,同学们进行了新的探究实验。