题目内容
【题目】某实验小组取部分变质的Ca(OH)2(含杂质CaCO3)样品4.0g投入200g水中,充分溶解,通入足量的CO2,固体质量与通入CO2质量的关系如图所示。已知:CaCO3+CO2+H2O=Ca(HCO3)2,生成的碳酸氢钙可完全溶解。试计算:
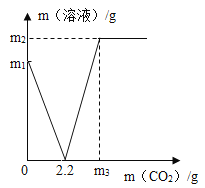
(1)当Ca(OH)2全部转化为CaCO3时消耗的CO2质量为___g。
(2)4.0样品中杂质CaCO3的质量分数为___(精确到0.1%)。
(3)当通入m3gCO2时,溶液中溶质的质量___。
【答案】2.2 7.5% 8.586g
【解析】
(1)当Ca(OH)2全部转化为CaCO3时消耗的CO2质量为2.2g;
(2)设样品中杂质Ca(OH)2的质量为x,生成碳酸钙的质量为y,
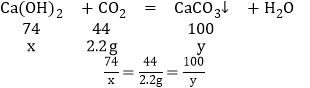
X=3.7g,y=5g
所以样品中杂质CaCO3的质量分数为![]() ;
;
(3)设当通入m3gCO2时,生成碳酸氢钙的质量为z,
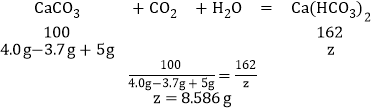
答:当通入m3gCO2时,溶液中溶质的质量为8.586g。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目