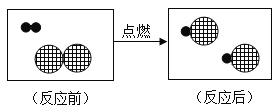
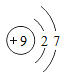题目内容
【题目】比较与分析归纳会使你的头脑变得更职明。请分析下表中信息,回答有关问题:
名称 | 符号 | 原子结构示意图 | 单质化学式 | 常温常压下状态 | 单质与氢气反应 |
氟 | F |
| F2 | _________ | 黑暗处爆炸 |
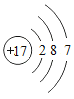
氯 | Cl |
| Cl2 | 气态 | 光照爆炸 |
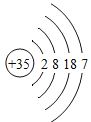
溴 | Br |
| Br2 | 液态 | 加热反应 |
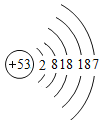
碘 | I |
| _________ | 固态 | 持续加热缓慢反应 |
(1)请写出上述表中的空格处应补充的内容
(2)试归纳氟、氯、溴、碘对应单质的性质变化规律(答一点即可):_________。已知:Cl2和Br2的化学性质相似,![]() ,其中/span>HClO也是一种酸,试写出Br2与水反应的化学方程式__________。
,其中/span>HClO也是一种酸,试写出Br2与水反应的化学方程式__________。
【答案】气态 I2 由气态逐渐变为液态、固态;或与氢气反应越来越缓慢 ![]()
【解析】
(1)氟气在常温下是气体,碘单质的化学式是I2;
(2)氟、氯、溴、碘对应单质的性质变化规律:由气态逐渐变为液态、固态;或与氢气反应越来越缓慢。根据氯气和单质溴的化学性质相似,以及方程式
Cl2+H2O=HCl+HClO,可知Br2与水反应的化学方程式![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】用“化学视角”认识身边的物质。
(1)空气
① 空气属于_________(填“混合物”或“纯净物”)。
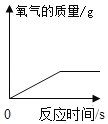
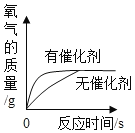
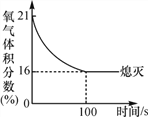
②如图是测定空气中氧气的体积分数实验,下列说法不正确的是__________。
A实验时红磷应足量 B点燃红磷前先用弹簧夹夹紧乳胶管
C红磷熄灭后立刻打开弹簧夹 D最终进入瓶中水的体积约为氧气的体积
(2)二氧化碳
①降温将二氧化碳制成干冰,这一过程发生______(填“物理变化”或“化学变化”)。
实验I | 实验II |
|
|
②实验I中可观察到甲试管中的紫色溶液变______色,乙试管的作用是___________。
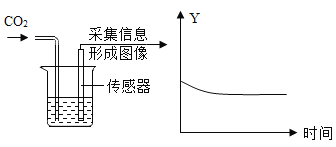
③实验II采用“数字化实验”,由传感器采集信息描绘出曲线,其中纵坐标Y可表示为烧杯中的______(填标号)。
A溶液的pH B溶液的质量 C二氧化碳体积
(3)水与溶液
①长期饮用硬水对人体健康不利,生活中常用______来区别硬水和软水。
②某固态物质的溶解度曲线如图所示。
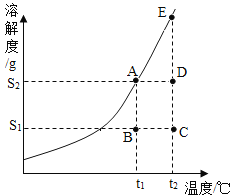
(i)A、B、C、D、E五点对应的溶液中,属于饱和溶液的有____________ 。
(ii)取用任意体积该固态物质饱和溶液时,下列物理量不随所取体积的多少而变化的是______。
A溶液中溶质的质量 B溶液的质量
C溶液的溶质质量分数 D溶液的密度
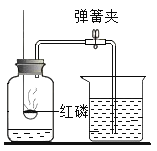
【题目】某工业铁红(Fe2O3)样品中可能混有一种黑色的金属氧化物杂质.根据工业制取铁红分析,该杂质可能是FeO或CuO,兴趣小组同学为探究样品中是否含有杂质及杂质的成分,进行如下实验.
(1)甲组同学分别取质量相等的样品和Fe2O3,加入试管Ⅰ、Ⅱ中,然后加入等体积稀硫酸进行如图对照实验,并得出结论:样品中不含杂质,你认为该结论__(填“合理”或“不合理”.)
(2)乙组同学按下列步骤进行实验:
收集资料
①上述三种氧化物在加热条件下,都能与氢气反应得到相应的金属单质和水.
②三种氧化物中氧元素的质量分数由大到小的顺序为__.
③铁粉中混有少量铜时,难以从金属颜色确定是否含有金属铜.
(3)设计方案进行实验
乙组同学用如图装置进行实验(碱石灰是氧化钙与氢氧化钠固体混合物).
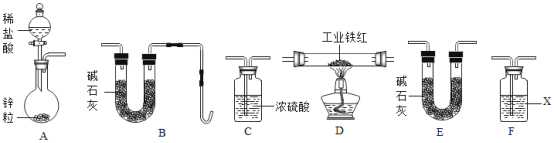
①乙组同学的实验装置中,依次连接的合理顺序为A→F→___→__→__→B,检查装置气密性后,向各装置中加入药品,装置F中试剂X是__溶液,
②下列实验操作步骤的合理顺序是__(填写操作编号).
a 加热装置D中反应管
b 检验H2的纯度
c 打开装置A中分液漏斗活塞,向圆底烧瓶中加入稀盐酸
③该实验处理尾气的方法是_____________________.
实验分析与结论
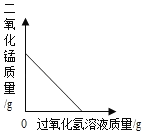
(4)乙组同学的两次实验数据如表:(两次实验工业铁红均与氢气完全反应)
实验编号 | 加入装置D中工业铁红的质量(g) | 实验后装置E的增重(g) |
1 | 8.0 | 2.6 |
2 | 16.0 | 5.2 |
①分析数据,你的实验结论是_____________.
②请帮助乙组同学设计实验方案确认该样品中杂质的成分______________.