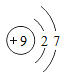题目内容
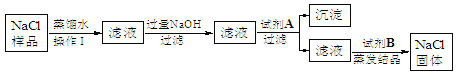
【题目】某工业铁红(Fe2O3)样品中可能混有一种黑色的金属氧化物杂质.根据工业制取铁红分析,该杂质可能是FeO或CuO,兴趣小组同学为探究样品中是否含有杂质及杂质的成分,进行如下实验.
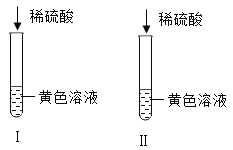
(1)甲组同学分别取质量相等的样品和Fe2O3,加入试管Ⅰ、Ⅱ中,然后加入等体积稀硫酸进行如图对照实验,并得出结论:样品中不含杂质,你认为该结论__(填“合理”或“不合理”.)
(2)乙组同学按下列步骤进行实验:
收集资料
①上述三种氧化物在加热条件下,都能与氢气反应得到相应的金属单质和水.
②三种氧化物中氧元素的质量分数由大到小的顺序为__.
③铁粉中混有少量铜时,难以从金属颜色确定是否含有金属铜.
(3)设计方案进行实验
乙组同学用如图装置进行实验(碱石灰是氧化钙与氢氧化钠固体混合物).
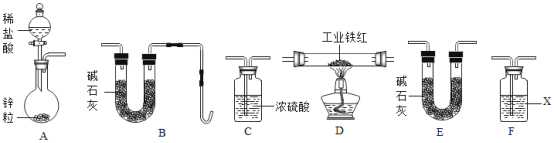
①乙组同学的实验装置中,依次连接的合理顺序为A→F→___→__→__→B,检查装置气密性后,向各装置中加入药品,装置F中试剂X是__溶液,
②下列实验操作步骤的合理顺序是__(填写操作编号).
a 加热装置D中反应管
b 检验H2的纯度
c 打开装置A中分液漏斗活塞,向圆底烧瓶中加入稀盐酸
③该实验处理尾气的方法是_____________________.
实验分析与结论
(4)乙组同学的两次实验数据如表:(两次实验工业铁红均与氢气完全反应)
实验编号 | 加入装置D中工业铁红的质量(g) | 实验后装置E的增重(g) |
1 | 8.0 | 2.6 |
2 | 16.0 | 5.2 |
①分析数据,你的实验结论是_____________.
②请帮助乙组同学设计实验方案确认该样品中杂质的成分______________.
【答案】不合理 氧化铁、氧化亚铁、氧化铜 C D E 氢氧化钠 cba 将氢气点燃或用气球收集 该工业铁红样品中含有FeO或CuO 取少量装置D中的固体于试管中,加入足量稀硫酸,震荡,若固体全部溶解,则含FeO,若固体不完全溶解,则含CuO
【解析】
(1)氧化铁与硫酸反应,生成硫酸铁,铁离子为黄色,固体中一定有氧化铁,和硫酸反应一定生成硫酸铁,溶液一定显黄色,故不合理;故填:不合理;
(2)把三种氧化物Fe2O3、FeO、CuO中氧原子个数变为3,则为Fe2O3、Fe3O3、Cu3O3,相对分子质量的大小为:Cu3O3>Fe3O3>Fe2O3相对分子质量越大,氧元素的质量分数越小,故三种氧化物中氧元素的质量分数由大到小的顺序为:氧化铁、氧化亚铁、氧化铜;故填:氧化铁、氧化亚铁、氧化铜;
(3)设计方案进行实验
①锌与盐酸反应生成氢气和水,盐酸具有挥发性,氢气从A中逸出时,常混有氯化氢和水蒸气,为得到干燥的氢气,氯化氢可以用氢氧化钠溶液吸收,浓硫酸具有吸水性,可以干燥氢气;然后通入D中与工业铁红反应,生成的水被碱石灰吸收,故乙组同学的实验装置中,依次连接的合理顺序为A→F→C→D→E→B;故填:C;D;E;氢氧化钠;
②实验操作步骤的合理顺序是:打开装置A中分液漏斗活塞,向圆底烧瓶中加入稀盐酸,收集一定量的氢气,检验H2的纯度,将纯净的氢气通入装置D中通一会,再加热装置D中反应管;否则易发生爆炸;故填:cba;
③该实验处理尾气的方法是将氢气点燃或用气球收集;故填:将氢气点燃或用气球收集。
实验分析与结论
(4)①假设8g工业铁红全部是氧化铁,氢气与8g氧化铁反应生成水的质量=8g×![]() ÷
÷![]() =2.7g
=2.7g
假设8g工业铁红全部是氧化亚铁,氢气与8g氧化亚铁反应生成水的质量=8g×![]() ÷
÷![]() =2g
=2g
假设8g工业铁红全部是氧化铜,氢气与8g氧化铜反应生成水的质量=8g×![]() ÷
÷![]() =1.8g,
=1.8g,
而表中数据为2.6g,可能含有的两种杂质生成的水都少于2.6g,说明样品中有杂质,若杂质为FeO,则产物为Fe,若杂质为CuO,则产物为Cu.该工业铁红样品中含有杂质或该工业铁红样品中含有FeO或CuO;故填:该工业铁红样品中含有FeO或CuO;
②取少量装置D中的固体于试管中,加入足量稀硫酸,震荡,若固体全部溶解,则含FeO,若固体不完全溶解,则含CuO。
故填:取少量装置D中的固体于试管中,加入足量稀硫酸,震荡,若固体全部溶解,则含FeO,若固体不完全溶解,则含CuO,因为铜与稀硫酸不反应。

 名校课堂系列答案
名校课堂系列答案【题目】比较与分析归纳会使你的头脑变得更职明。请分析下表中信息,回答有关问题:
名称 | 符号 | 原子结构示意图 | 单质化学式 | 常温常压下状态 | 单质与氢气反应 |
氟 | F |
| F2 | _________ | 黑暗处爆炸 |
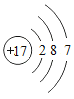
氯 | Cl |
| Cl2 | 气态 | 光照爆炸 |
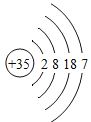
溴 | Br |
| Br2 | 液态 | 加热反应 |
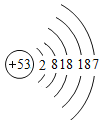
碘 | I |
| _________ | 固态 | 持续加热缓慢反应 |
(1)请写出上述表中的空格处应补充的内容
(2)试归纳氟、氯、溴、碘对应单质的性质变化规律(答一点即可):_________。已知:Cl2和Br2的化学性质相似,![]() ,其中/span>HClO也是一种酸,试写出Br2与水反应的化学方程式__________。
,其中/span>HClO也是一种酸,试写出Br2与水反应的化学方程式__________。
【题目】请回忆你学习过的“质量守恒定律”的实验探究,并按要求完成实验方案一和实验方案二。(下表中“实验结论”填“=”“>”或“<”)
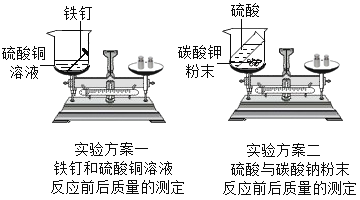
实验方案 | 方案一 | 方案二 |
反应现象 | 铁钉表面覆盖一层红色的物质,溶液由蓝色变成__________色 | 有气泡产生 |
化学方程式 | ________________ | H2SO4+K2CO3= K2SO4+CO2 |
反应前的总质量 | m1 | n1 |
反应后的总质量 | m2 | n2 |
实验结论 | m1_______m2 | n1________n2 |
将两个实验结果进行讨论对比时,有同学有一个方案观察到天平不平衡,是因为________,因此不能说质量不守恒。在反应物不变的前提下,要使天平平衡,你对该方案的改进措施是___________。
【题目】小红进行酸碱中和反应的实验(如图所示).她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂,为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化.于是她对烧杯中的溶液进行了以下探究:
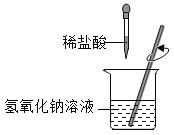
(1)小红认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应;②氢氧化钠有剩余;③盐酸过量.
小明同学却断定不可能“氢氧化钠有剩余”,他的理由是:_____;
(2)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证.请根据相关内容填写如表:
试验方法 | 可能观察到的现象 | 结论 |
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中. | 如果______ | 则盐酸过量 |
如果______ | 盐酸与氢氧化钠恰好完全反应 |
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的.你认为其中不正确的是____(填序号).
A生锈的铁钉 B碳酸钠粉末 C硫酸钠粉末 D氢氧化铜
(4)若采用pH试纸证明该反应恰好中和,具体方法为__________。