题目内容
【题目】氧气具有广泛的用途,某化学小组进行有关氧气制备的探究.
Ⅰ.氧气的制备原理.
(1)工业上利用气体的_____(填“物理”或“化学”)性质不同来分离液态空气制备氧气.
(2)实验室常用过氧化氢溶液、氯酸钾、高锰酸钾等为原料制备氧气,其中氯酸钾制备氧气的化学方程式为_____________________,该反应类型为___________.
(3)植物通过光合作用吸收_______气体,呼出氧气.
Ⅱ.过氧化氢分解速率影响因素探究
小组同学用用数字化实验探究外界条件对过氧化氢分解速率的影响,实验装置如下:
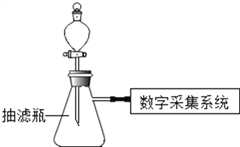
(进行实验)
序号 | 主要实验步骤 | 装置内压强﹣时间图象 |
实 验 1 | ①1号抽滤瓶中不加任何试剂. 2号抽滤瓶中加入0.2gMnO2粉末, 3号抽滤瓶中加入0.2gFeCl3粉末 ②用三支分液漏斗分别加入15mL4%的H2O2溶液 |
|
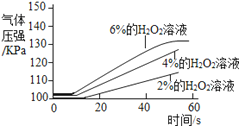
实 验 2 | ①三个抽滤瓶中分别加入0.2g FeCl3粉末 ②分别用1号分液漏斗加入15mL 2%的H2O2溶液;用2号分液漏斗加入15mL 4%的H2O2溶液;用3号分液漏斗加入15mL 6%的H2O2溶液 |
|
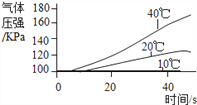
实 验 3 | ①三个抽滤瓶中分别加入0.2g FeCl3粉末 ②_____________________________。 ③_____________________________。 |
|
(结果与分析)
(4)实验1的目的是_____,结论是_____,3号抽滤瓶中发生的化学反应方程式为________________.
(5)实验2可得出过氧化氢的浓度越大,反应速率越快的结论,则图中曲线a代表的溶液是__________________.
(6)通过上述实验可知影响H2O2分解速率的外界因素有_____________.
(反思与评价)
(7)经过多长实验,有的同学对比实验1和3号瓶、实验2的2号瓶中同为40s时的气体压强,发现存在较大的差异,可能的原因是_____.
【答案】物理 2KClO3 ![]() 2KCl + 3O2↑ 分解反应 CO2或二氧化碳 将三个抽滤瓶分别放入装有10℃、20℃、40℃水的水槽中 用三支分液漏斗分别加入15mL4%(或2%或6%)的H2O2溶液 探究不同催化剂对过氧化氢分解速率的影响 MnO2的催化作用比 FeCl3的催化作用强或MnO2比FeCl3更能加快H2O2的分解速率 2H2O2
2KCl + 3O2↑ 分解反应 CO2或二氧化碳 将三个抽滤瓶分别放入装有10℃、20℃、40℃水的水槽中 用三支分液漏斗分别加入15mL4%(或2%或6%)的H2O2溶液 探究不同催化剂对过氧化氢分解速率的影响 MnO2的催化作用比 FeCl3的催化作用强或MnO2比FeCl3更能加快H2O2的分解速率 2H2O2 ![]() 2H2O+O2↑ 【答题空10】6%的H2O2溶液 浓度、温度、催化剂 实验1和实验2 的温度不同
2H2O+O2↑ 【答题空10】6%的H2O2溶液 浓度、温度、催化剂 实验1和实验2 的温度不同
【解析】
(1)工业制取氧气是根据各成分沸点的不同加以分离的方法,沸点属于物理性质; (2)氯酸钾在二氧化锰作催化剂、加热的条件下分解为氯化钾和氧气,化学方程式为:2KClO3 ![]() 2KCl + 3O2↑;该反应符合“多变一”的特征,属于分解反应;(3)光合作用是绿色植物吸收二氧化碳,释放出氧气的过程;【进行实验】探究在不同温度下过氧化氢的分解速率,①三个抽滤瓶中分别加入0.2gFeCl3粉末;②将三个抽滤瓶分别放在装有10℃、20℃和40℃水的水槽中;③用三支分液漏斗分别加入等体积、等浓度的过氧化氢溶液;【结果与分析】
2KCl + 3O2↑;该反应符合“多变一”的特征,属于分解反应;(3)光合作用是绿色植物吸收二氧化碳,释放出氧气的过程;【进行实验】探究在不同温度下过氧化氢的分解速率,①三个抽滤瓶中分别加入0.2gFeCl3粉末;②将三个抽滤瓶分别放在装有10℃、20℃和40℃水的水槽中;③用三支分液漏斗分别加入等体积、等浓度的过氧化氢溶液;【结果与分析】
(4)由实验可知,该实验是探究不同催化剂对过氧化氢分解速率的影响;由气体压强变化情况可知,二氧化锰的催化效果比氯化铁的催化效果强,过氧化氢在氯化铁的催化作用下分解为水和氧气化学反应方程式为:2H2O2 ![]() 2H2O+O2↑;(5)因为过氧化氢的浓度越大,反应速率越快,所以a曲线代表浓度最大的溶液;(6)由实验探究可知,反应物的浓度、温度以及催化剂的种类对化学反应的速率都有影响;(7)由于实验1和实验2的温度不同,所以气体压强存在比较大的差异。
2H2O+O2↑;(5)因为过氧化氢的浓度越大,反应速率越快,所以a曲线代表浓度最大的溶液;(6)由实验探究可知,反应物的浓度、温度以及催化剂的种类对化学反应的速率都有影响;(7)由于实验1和实验2的温度不同,所以气体压强存在比较大的差异。