题目内容
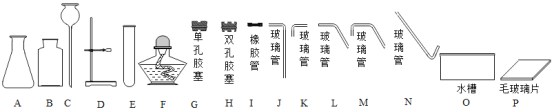
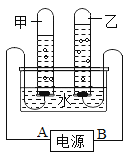
【题目】下图是实验室制取气体的常用装置。回答下列问题:
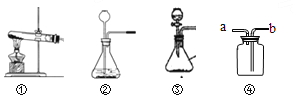
(1)写出实验室用①制备的一种气体的化学方程式。
____________________________________
(2)装置③和②相比,③的优点是什么?
____________________________________
【答案】2KMnO4 K2MnO4+MnO2+O2↑ 通过控制液体的滴加速率来控制反应速率
【解析】
(1)该制取气体装置是用于固体加热制取气体,且在试管口有一棉花团,是用高锰酸钾加热来制取氧气,故反应的化学方程式:2KMnO4![]() K2MnO4+MnO2+O2↑; (2)装置③的优点是能控制反应的停止和开始以及反应的速率;故填:控制液体的滴加速率。
K2MnO4+MnO2+O2↑; (2)装置③的优点是能控制反应的停止和开始以及反应的速率;故填:控制液体的滴加速率。

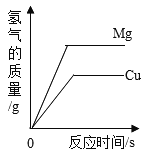
【题目】氧气具有广泛的用途,某化学小组进行有关氧气制备的探究.
Ⅰ.氧气的制备原理.
(1)工业上利用气体的_____(填“物理”或“化学”)性质不同来分离液态空气制备氧气.
(2)实验室常用过氧化氢溶液、氯酸钾、高锰酸钾等为原料制备氧气,其中氯酸钾制备氧气的化学方程式为_____________________,该反应类型为___________.
(3)植物通过光合作用吸收_______气体,呼出氧气.
Ⅱ.过氧化氢分解速率影响因素探究
小组同学用用数字化实验探究外界条件对过氧化氢分解速率的影响,实验装置如下:
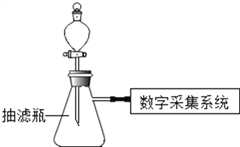
(进行实验)
序号 | 主要实验步骤 | 装置内压强﹣时间图象 |
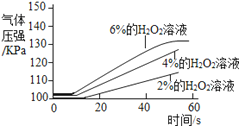
实 验 1 | ①1号抽滤瓶中不加任何试剂. 2号抽滤瓶中加入0.2gMnO2粉末, 3号抽滤瓶中加入0.2gFeCl3粉末 ②用三支分液漏斗分别加入15mL4%的H2O2溶液 |
|
实 验 2 | ①三个抽滤瓶中分别加入0.2g FeCl3粉末 ②分别用1号分液漏斗加入15mL 2%的H2O2溶液;用2号分液漏斗加入15mL 4%的H2O2溶液;用3号分液漏斗加入15mL 6%的H2O2溶液 |
|
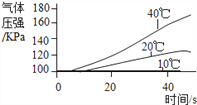
实 验 3 | ①三个抽滤瓶中分别加入0.2g FeCl3粉末 ②_____________________________。 ③_____________________________。 |
|
(结果与分析)
(4)实验1的目的是_____,结论是_____,3号抽滤瓶中发生的化学反应方程式为________________.
(5)实验2可得出过氧化氢的浓度越大,反应速率越快的结论,则图中曲线a代表的溶液是__________________.
(6)通过上述实验可知影响H2O2分解速率的外界因素有_____________.
(反思与评价)
(7)经过多长实验,有的同学对比实验1和3号瓶、实验2的2号瓶中同为40s时的气体压强,发现存在较大的差异,可能的原因是_____.