题目内容
【题目】海水晒盐可制得粗盐,粗盐除氯化钠外,还含有 MgCl2、CaCl2、Na2SO4 以及泥沙等杂质,以下是某化学兴趣小组制定的一套制备精盐的实验方案,步骤如图所示:

(查阅资料)
可溶性钡盐有剧毒,可以导致蛋白质变性,破坏体内各种酶,使一系列生理活动被破坏。
(交流与表达)
(1)步骤①中玻璃棒的作用是__________,溶解粗盐时所加水的质量不宜过多,也不宜 过少,过多会造成__________,过少会使得精盐的产率__________(填“偏高”或“偏 低”)。
(2)下列试剂 X 符合要求的是__________(选填字母)。
A氧化钙 B氢氧化钡溶液 C氢氧化钠溶液 D氢氧化钙溶液 E氢氧化钾溶液
(3)氯化钡溶液和碳酸钠溶液的添加顺序__________(填“能”或“不能”)颠倒,沉淀 B 中的成分是 BaSO4、CaCO3 和(填化学式)_________,加入盐酸的作用是__________。
(4)某同学为了证明溶液 C 是否有盐酸剩余,设计的下列方法中正确的是_________(选填字母)。
A取样,加入铜,若无现象,说明盐酸没有剩余
B取样,测溶液 pH,若 pH<7,说明盐酸有剩余
C取样,加碳酸钠溶液,若有气泡产生,说明有盐酸剩余
D取样,加硝酸银溶液,若有白色沉淀产生,说明有盐酸剩
(反思与评价)
(5)小刚同学认为该方案实际得到的氯化钠比原粗盐中含有的氯化钠要多,请你为他找出理由_________。
【答案】加速溶解 造成蒸发时浪费燃料并且耗时长 偏低 ABCD 不能 BaCO3、Mg(OH)2 除去过量的碳酸钠、氢氧化钠 BC 反应生成了氯化钠
【解析】
(1)步骤①中玻璃棒的作用是加速溶解;溶解粗盐时所加水的质量不宜过多,也不宜过少,过多会造成蒸发时浪费燃料并且耗时长;溶解粗盐时,所加水的质量过少,会导致氯化钠不能完全溶解,从而会使得粗盐的产率偏低;
(2)氯化钡与硫酸镁生成硫酸钡和氯化镁,能除去硫酸镁;碳酸钠与氯化钙反应生成碳酸钙和氯化钠,能除去氯化钙,根据题意可知,加入X是除去氯化镁。
A、氧化钙能和水反应生成氢氧化钙,氢氧化钙能和氯化镁反应生成氢氧化镁沉淀和氯化钙,碳酸钠能与过量的氢氧化钙反应生成碳酸钙和氢氧化钠,能除去过量氢氧化钙,因此氧化钙符合要求;
B、氢氧化钡能和氯化镁反应生成氢氧化镁沉淀和氯化钡,氢氧化钡和氯化钡都能与碳酸钠反应生成碳酸钡沉淀,过量的碳酸钠能除去过量的氢氧化钡和生成的氯化钡,因此氢氧化钡符合要求;
C、氢氧化钠能和氯化镁反应生成氢氧化镁沉淀和氯化钠,因此氢氧化钠符合要求;
D、氢氧化钙能和氯化镁反应生成氢氧化镁沉淀和氯化钙,因此氢氧化钙符合要求;
E,氢氧化钾和氯化镁反应生成氢氧化镁沉淀和氯化钾,氯化钾在以后步骤中不能除去,因此氢氧化钾不符合要求。故选ABCD;
(3)氯化钡溶液和碳酸钠溶液的添加顺序不能颠倒,这是因为如果颠倒后过滤的氯化钡不能除去;沉淀B中的成分是BaSO4和反应生成的CaCO3、BaCO3、Mg(OH)2;碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,氢氧化钠与盐酸反应生成氯化钠和水,加入盐酸的作用是除去过量的碳酸钠、氢氧化钠;
(4)A、取样,加入铜,若无现象,不能说明盐酸没有剩余,这是因为铜不能和稀盐酸反应;
B、取样,测溶液pH,若pH<7,说明盐酸有剩余;
C、取样,加碳酸钠溶液,若有气泡产生,说明有盐酸剩余;
D、取样,加硝酸银溶液,若有白色沉淀产生,不能说明有盐酸剩余,这是因为氯化钠能和硝酸银反应生成白色沉淀氯化银。故选BC;
(5)该方案实际得到的氢化钠比原粗盐中含有的氯化钠要多,是因为加入试剂X(氢氧化钠等)、氯化钡、碳酸钠除杂时都生成了氯化钠。

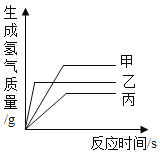
【题目】暖贴发热是利用了铁粉生锈放出热量的原理,某小组同学设计并进行实验,探究铁生锈的条件及影响生锈速率的因素。
I.探究铁生锈的条件
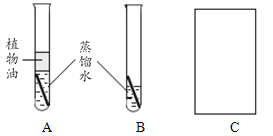
(1)由实验B和C得出铁生锈需要与水接触,画出实验C的实验装置图。__________
(2)证明铁生锈需要与氧气接触的实验现象是____________。
II.探究影响铁生锈速率的因素
(查阅资料)暖贴的发热材料主要有铁粉、活性炭、食盐、水等物质。
(猜想假设)
(1)活性炭能加快铁粉生锈的速率。
(2)食盐能加快铁粉生锈的速率。
(进行实验)下表是2g铁粉、5g水与不同量活性炭、食盐均匀混合后,在10分钟内温度上升的实验记录。
实验编号 | 活性炭/g | 食盐/g | 温度上升值/℃ |
1 | 0 | 0 | 0.1 |
2 | 0.2 | 0 | 22.0 |
3 | x | 0.1 | 3.1 |
4 | 0.2 | 0.1 | 56.3 |
(解释与结论)
(3)表中x的值为____________。
(4)对比实验1和3,得出的结论是____________。
(5)欲得出结论“活性炭与食盐同时存在会大幅度加快铁生锈速率”,需要对比________(填实验编号)。
(反思与评价)
(6)下列说法正确的是_______。
A.暖贴在使用前要密封保存
B.暖贴使用后剩余物可以回收利用
C.利用铁生锈的原理,铁粉还可用于食品保鲜
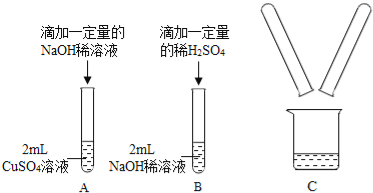
【题目】某化学兴趣小组在实验室做了如图所示的A、B两个实验.
(1)B实验中发生反应的化学方程式为 .
(2)A、B两个实验结束后,小明同学将两支试管中的物质同时加入一纯净的烧杯中(如图C所示),混合后,观察到烧杯中有蓝色沉淀.同学们将烧杯内的物质过滤,对所得滤液中溶质的成分进行探究.
(猜想)
小明猜想:滤液中的溶质是Na2SO4、CuSO4;
小光猜想:滤液中的溶质是Na2SO4、NaOH;
小英猜想:滤液中的溶质是Na2SO4、CuSO4、H2SO4;
你的猜想:滤液中的溶质还可能是 .
(讨论)你认为 的猜想一定不合理.如果滤液为无色,还可排除 的猜想,理由是 .
(实验)若小光的猜想正确,请完成下表的方案.
实验步骤 | 预想的实验现象 | 实验结论 |
取少量滤液与试管中,滴入 | | 小光的猜想正确 |