题目内容
【题目】现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2价)。下列说法中不正确的是( )
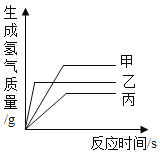
A.生成氢气的质量:甲>乙>丙
B.相对原子质量:乙>丙>甲
C.金属活动性:乙>甲>丙
D.消耗硫酸的质量:甲>乙>丙
【答案】B
【解析】
A、根据图象分析生成氢气的质量;
B、根据甲、乙、丙在生成物中化合价均为+2价可知一定质量的金属完全反应产生氢气的质量与金属的相对原子质量成反比分析;
C、根据相同时间内产生氢气较多(即反应剧烈)的金属活动性较强,结合产生氢气的关系图判断三种金属活动性;
D、根据质量守恒定律定律可知,生成氢气的质量取决于消耗的硫酸的质量。
A、根据图像可知,生成氢气的质量:甲>乙>丙,该选项说法正确;
B、等质量甲、乙、丙三种金属粉末与足量稀硫酸反应,甲、乙、丙在生成物中化合价均为+2价,则相对原子质量越大,产生氢气质量越小,根据生成氢气质量:甲>乙>丙,则相对原子质量:丙>乙>甲,该选项说法不正确;
C、根据反应生成H2的质量与反应时间的关系图所示,当三种金属都在发生反应时,相同时间内乙放出氢气的质量大于甲、大于丙,可判断三种金属活动性顺序是乙>甲>丙,该选项说法正确;
D、金属与酸的反应生成氢气时,氢气来源于酸中的氢元素,所以生成的氢气与消耗的酸的多少顺序一致,消耗硫酸的质量:甲>乙>丙,该选项说法正确。
故选:B。

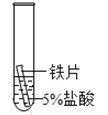
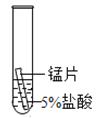
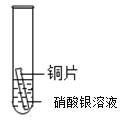
【题目】某研究小组为探究铁、铜、锰(Mn)、银的金属活动性顺序,进行了如下三个实验(其中金属均已打磨,且形状、大小相同,试管中所用溶液的体积相同)。下列判断不正确的是
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
实验现象 | 立即产生气泡,速率较慢 | 立即产生气泡,速率较快 | 铜片的表面有银白色固体,一段时间后。溶液由无色变为蓝色 |
A.通过实验一和实验二的反 应剧烈程度,能判断出铁和锰的金属活动性强弱
B.在上述三个实验基础上再增加一个铜和5%盐酸的实验,则能判断出四种金属的活动性顺序
C.通过上述三个实验,能判断出四种金属的活动性顺序
D.通过实验三的反应现象,能判断出铜和银的金属活动性强弱
【题目】某同学向一定质量的石灰石中加入7.3%的稀盐酸来制取二氧化碳,测得反应过程中溶液的pH与加入的稀盐酸的关系如右图所示。

(1)该同学能收集到的二氧化碳的质量多少?(写出计算过程)
(2)该同学把制取气体后的废液过滤,向滤液中加入10.6%的Na2CO3溶液,测得加入的Na2CO3溶液与产生的沉淀数据如下:
Na2CO3溶液质量/g | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
沉淀质量/g | 0 | 1 | n | 3 | 4 | 5 | m |
则m= 。加入10gNa2CO3溶液时发生反应的化学方程式是 。
请在右图中画出向废液中加入Na2CO3溶液时加入的Na2CO3溶液与产生的沉淀的曲线。

【题目】在学习金属的化学性质时,老师在课堂上给学生们演示了如图实验:
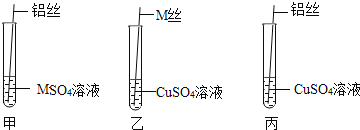
(给出资料)M是一种金属,![]() 溶液是无色液体。
溶液是无色液体。
(实验目的)探究M与铜、铝的活动性顺序。
(猜想与假设)
猜想Ⅰ:![]() ;
;
猜想Ⅱ:![]() ;
;
猜想Ⅲ:_____。
(进行实验)
第一步:老师取出M丝、铜丝、铝丝用砂纸进行打磨,目的是_____。
第二步:老师按照如图进行实验操作,要求同学们填写如下表格:
实验操作 | 实验想象 | 实验结论 |
铝丝插入装有 | 铝丝表面出现一层黑色物质 | _____ |
M丝插入装有 | M丝表面出现一层红色物质,溶液的颜色_____。 | M>Cu |
铝丝插入装有 | M丝表面出现一层红色物质,颜色由蓝色变为无色 | Al>Cu |
第三步:根据表格,可判断猜想_____正确。
(交流表达)
老师要求同学们写出试管丙中反应的化学方程式_____。然后经同学们讨论后大家认为该实验可以优化,去掉试管_____![]() 填试管编号
填试管编号![]() 中的实验,也可以得出正确的结论。
中的实验,也可以得出正确的结论。
(评价与反思)
实验结束后,同学对实验过程进行了如下反思:如果M能够和稀酸溶液反应,探究金属![]() 铜、铝活动性顺序时,除了上述实验中已经用到的方法外,还可以根据_____进行判断
铜、铝活动性顺序时,除了上述实验中已经用到的方法外,还可以根据_____进行判断![]() 任写一种
任写一种![]() 。
。