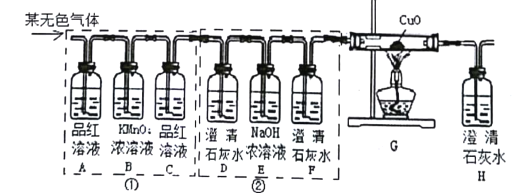
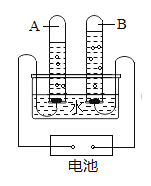
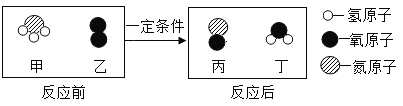
题目内容
【题目】对比实验、控制变量是学习化学的重要方法,下列对比实验不能达到目的的是( )
编号 | A | B | C | D |
实验设计 |
|
|
|
|
实验目的 | 探究 | 探究物质燃烧的条件 | 探究生锈条件 | 探究 |
A. A B. B C. C D. D
【答案】A
【解析】
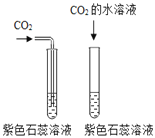
A、过程中没有设计二氧化碳能否使干燥石蕊变红色的实验,因此该选项对比实验不能达到实验目的;
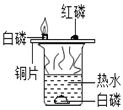
B、实验过程中,铜片上的白磷燃烧,红磷不能燃烧,说明燃烧需要温度达到可燃物着火点,水中的白磷不能燃烧,说明燃烧需要氧气参加,该选项能够达到实验目的;
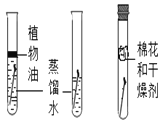
C、实验过程中,两边试管中的铁钉无明显现象,说明铁只和水或氧气接触不能生锈,中间试管中的铁钉生锈,说明铁和水、氧气同时接触时容易生锈,该选项能够达到实验目的;
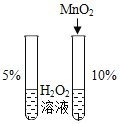
D、实验过程中,加入二氧化锰的试管产生气泡快且多,说明二氧化锰能够加快过氧化氢的分解速率,该选项能够达到实验目的。
故选:A。

 阅读快车系列答案
阅读快车系列答案【题目】学习了金属的性质后,同学们设计了以下实验验证铁铜银的金属活动性顺序
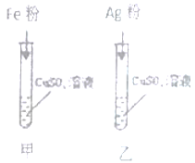
(1)能证明铁铜银活动性顺序的现象是________。
(2)甲试管内的化学反应方程式为________。
(3)实验结束后,将甲乙试管内的剩余物质都倒在一起,充分反应过滤,得到滤渣和滤液。
探究一、A组同学对滤渣的成分进行探究,向滤渣中加入稀盐酸,观察到无气泡产生,滤渣的成分为_______。
探究二、B组同学对滤液成分进行探究,提出猜想
猜想一:溶质只有FeSO4猜想二:_________
设计实验
实验步骤 | 实验现象 | 结论 |
取一定量滤液于试管中,____ | ________ | 猜想二正确 |
【题目】徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入10g | 3.0g |
第二次加入10g | 2.0g |
第三次加入10g | 1.0g |
第四次加入10g | 0.6g |
请计算:
(1)4.0g石灰石样品中碳酸钙的质量是____g。
(2)10g稀盐酸能与_____g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数为_________(写出计算过程,结果精确到0.1%)