题目内容
【题目】Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含MgSO4和H2SO4的混合溶液。为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:
实验编号 | ① | ② | ③ | ④ |
NaOH溶液质量/g | 10.0 | 20.0 | 30.0 | 40.0 |
Mg(OH)2质量/g | 0.232 | 0.522 | 0.580 | 0.580 |
(1)实验 (填实验编号)中硫酸镁完全反应;
(2)计算100g混合溶液中含Mg元素的质量(写出计算过程);
(3)求生成0.580g沉淀时加入4%NaOH溶液的质量(写出计算过程)
【答案】(1)③④ (2)0.24g (3)22.0g
【解析】
(1)由图可知,加入氢氧化钠溶液后,氢氧化钠先与硫酸反应,所以实验②与实验①生成的氢氧化镁沉淀的质量差是就是10g氢氧化钠溶液与硫酸镁生成的氢氧化镁的质量,即该质量=0.522g0.232g=0.29g,实验③中如果氢氧化钠完全反应,则生成的氢氧化镁的质量=0.522g+0.29g=0.812g,但实验③中实际生成氢氧化镁沉淀的质量0.580g<0.812g,所以实验③中氢氧化钠有剩余,则硫酸镁全部参加反应,实验④中比实验③中多加了10g氢氧化钠溶液,但氢氧化镁沉淀的质量并没有增加,证明实验④中的硫酸镁也全部参加反应,故填③④。
(2)解:设100g混合溶液中含有MgSO4的质量是x
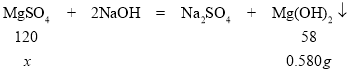
120:58=x:0.580g
x=1.2g
100g混合溶液中含Mg元素的质量=1.2g×![]() ×100%=0.24g
×100%=0.24g
答:100g混合溶液中含Mg元素的质量是0.24g。
(3)解:由(1)可知,每消耗10.0gNaOH溶液生成氢氧化镁沉淀0.522g-0.232g=0.29g
设第一次与硫酸镁反应的氢氧化钠溶液质量为y
10.0g:0.29g=y:0.232g
y=8.0g
则与硫酸反应的氢氧化钠溶液的质量为10.0g8.0g=2.0g
设与硫酸镁反应的氢氧化钠的总质量为z
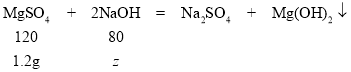
120:80=1.2g:z
z=0.8g
则与硫酸镁反应的氢氧化钠溶液的总质量=0.8g÷4%=20g
生成0.580g沉淀时加入4%NaOH溶液的质量=20g+2.0g=22.0g
答:生成0.580g沉淀时加入4%NaOH溶液的质量是22.0g。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】根据图示回答相关问题。
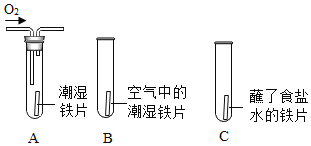
(1)下列通过对照实验探究影响铁生锈的因素。
实验 | 分析 |
| 一段时间后发现A、C 中铁片变红,B中铁片依然光亮,对比A、B中的现象,说明决定铁生锈快慢的一个重要因素是___________;对比B、C中的现象,说明铁生锈快慢与____________有关。 |
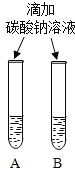
(2)小明同学设计如下两种方案鉴别氢氧化钠和氢氧化钙两种饱和溶液。
实验一 | 实验二 | 分析 |
|
| 两种方案中均观察到B试管内出现白色浑浊,则B中溶液为______(填名称) ;实验二的设计原理是_____________。 |