题目内容
【题目】某课外活动小组按右图所示装置制取二氧化碳,并检验二氧化碳的性质:
(1)若用装置B来证明二氧化碳与水反应生成碳酸,B中除有少量水外,还应加入的试剂是,当①、②导管口连接时,B中看到的实验现象是: , 其反应的化学方程式为:。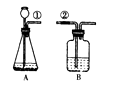
当导管断开一段时间后,看到B中的现象是 , 其反应的化学方程式为 .
(2)为测定当地石灰石含碳酸钙的质量分数,该课外活动小组取来一些矿石,并取稀盐酸200g,将其平均分成4份,进行实验,其结果如下:
实验 | 第1份 | 第2份 | 第3份 | 第4份 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.54 | 3.08 | 4.4 | m |
依据表中数据请分析计算:
①项反应中盐酸有剩余。
②上表中m的数值是。
③试计算这种石灰石中碳酸钙的质量分数 。
【答案】
(1)石蕊溶液,石蕊溶液由紫色变红色CO2+H2O=H2CO3,红色逐渐消失又变紫色,H2CO3=H2O+CO2↑
(2)第一、二份,4.4,70%
【解析】根据所学知识和题中信息知,若用装置B来证明二氧化碳与水反应生成碳酸,B中除有少量水外,还应加入的试剂是石蕊溶液,当①、②导管口连接时,B中看到的实验现象是:石蕊溶液由紫色变红色,其反应的化学方程式为:CO2+H2O=H2CO3当导管断开一段时间后,看到B中的现象是红色逐渐消失又变紫色,其反应的化学方程式为:H2CO3=H2O+CO2↑。依据表中数据请分析计算:①哪几项反应中盐酸有剩余。第一、二份。②上表中m的数值是4.4。③设碳酸钙的质量为x
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
100 | 44 | ||
x | 1.54g |
解得x=3.5g
3.5g/5g*100%=70%
答∶这种石灰石中碳酸钙的质量分数70%。
【考点精析】解答此题的关键在于理解二氧化碳的化学性质的相关知识,掌握化学性质:一般情况下不能燃烧,也不支持燃烧,不能供给呼吸;与水反应生成碳酸;能使澄清的石灰水变浑浊;与灼热的碳反应,以及对书写化学方程式、文字表达式、电离方程式的理解,了解注意:a、配平 b、条件 c、箭号.

 阅读快车系列答案
阅读快车系列答案