题目内容
【题目】根据下列实验装置图,回答有关问题,
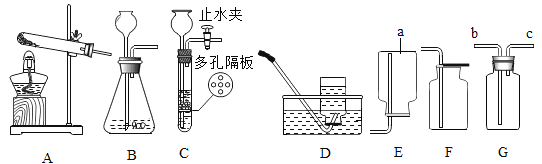
(1)装置图中仪器a的名称为_____。
(2)用氯酸钾和二氧化锰混合制取氧气,可选用的发生装置是_____(填字母),写出该反应的化学方程式_____;若用D装置收集氧气,当导管口气泡_____冒出时,再把导管口伸入盛满水的集气瓶。
(3)实验室用B装置制取二氧化碳的化学方程式为_____,如果用G装置收集气体,气体应从_____(填“b”或“c”)端通入;用C装置代替B装置,收集所需的气体量后,对C装置进行的操作是_____。
(4)氮的氧化物(NO2)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NO2还原成N2,某同学在实验室中对NH3与NO2的反应进行了探究。
(资料:NO2有毒,常温下为红棕色,实验中常用氢氧化钠溶液进行尾气处理;同温同压下,不同气体的体积之比等于分子个数之比。)
现将收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按下图装置进行实验。
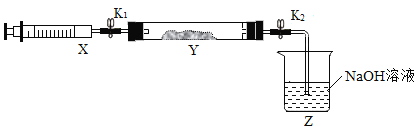
(Ⅰ)打开K1,推动注射器活塞,使X中的气体缓慢通入Y中,Y管中的现象_____,反应方程式是_____。
(Ⅱ)将注射器活塞退回原处并固定,待装置恢复到室温,Y中有少量水珠。
(Ⅲ)打开K2,观察到的现象_____,原因是_____。
【答案】集气瓶 A 2KClO3![]() 2KCl+3O2↑ 连续均匀 CaCO3+2HCl=CaCl2+CO2↑+H2O b 关闭出口止水夹 硬质玻璃管内气体由红棕色变为无色 8NH3+6NO2
2KCl+3O2↑ 连续均匀 CaCO3+2HCl=CaCl2+CO2↑+H2O b 关闭出口止水夹 硬质玻璃管内气体由红棕色变为无色 8NH3+6NO2 7N2+12H2O 烧杯中的液体流入硬质玻璃管 氨气和氮气反应,反应后气体减少,故硬质玻璃管内气压降低。
7N2+12H2O 烧杯中的液体流入硬质玻璃管 氨气和氮气反应,反应后气体减少,故硬质玻璃管内气压降低。
【解析】
(1)由图可知a为集气瓶。故填:集气瓶。
(2)氯酸钾在二氧化锰催化作用下,加热的情况下可以反应生成氯化钾和氧气,化学方程式为2KClO3![]() 2KCl+3O2↑,该反应需要加热故选用的发生装置为A,若用D装置收集氧气,当导管口气泡连续均匀冒出时,再收集,故填:A;2KClO3
2KCl+3O2↑,该反应需要加热故选用的发生装置为A,若用D装置收集氧气,当导管口气泡连续均匀冒出时,再收集,故填:A;2KClO3![]() 2KCl+3O2↑;连续均匀。
2KCl+3O2↑;连续均匀。
(3)实验室用石灰石或大理石和稀盐酸反应制取二氧化碳,石灰石或大理石主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O, 如果用G装置收集CO2,因为二氧化碳密度比空气大,气体应从b端通入;用C装置代替B装置,优点是随开随用,随关随停,在装置C中,固体药品放在多孔隔板上,液体药品从长颈漏斗中加入,反应开始后,关闭开关时,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止,打开开关时,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行。故收集所需的气体量后,对C装置进行的操作是关闭出口止水夹,故填:CaCO3+2HCl=CaCl2+CO2↑+H2O;b;关闭出口止水阀。
(4)(Ⅰ)工业上在一定温度和催化剂条件下用NH3将NO2还原成N2,根据质量守恒还会有水生成,化学方程式为8NH3+6NO2 7N2+12H2O ,现象为硬质玻璃管内气体由红色变为无色,故填:硬质玻璃管内气体由红色变为无色;8NH3+6NO2
7N2+12H2O ,现象为硬质玻璃管内气体由红色变为无色,故填:硬质玻璃管内气体由红色变为无色;8NH3+6NO2 7N2+12H2O。
7N2+12H2O。
(Ⅲ)打开K2,观察到的现象水流入硬质玻璃管,原因是氨气和氮气反应,反应后生成气体分子数变少,气体体积减少,故硬质玻璃管内气压降低。

 名校课堂系列答案
名校课堂系列答案【题目】在学习金属的化学性质时,老师在课堂上给学生们演示了如图实验:
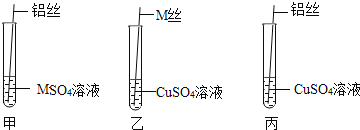
(给出资料)M是一种金属,![]() 溶液是无色液体。
溶液是无色液体。
(实验目的)探究M与铜、铝的活动性顺序。
(猜想与假设)
猜想Ⅰ:![]() ;
;
猜想Ⅱ:![]() ;
;
猜想Ⅲ:_____。
(进行实验)
第一步:老师取出M丝、铜丝、铝丝用砂纸进行打磨,目的是_____。
第二步:老师按照如图进行实验操作,要求同学们填写如下表格:
实验操作 | 实验想象 | 实验结论 |
铝丝插入装有 | 铝丝表面出现一层黑色物质 | _____ |
M丝插入装有 | M丝表面出现一层红色物质,溶液的颜色_____。 | M>Cu |
铝丝插入装有 | M丝表面出现一层红色物质,颜色由蓝色变为无色 | Al>Cu |
第三步:根据表格,可判断猜想_____正确。
(交流表达)
老师要求同学们写出试管丙中反应的化学方程式_____。然后经同学们讨论后大家认为该实验可以优化,去掉试管_____![]() 填试管编号
填试管编号![]() 中的实验,也可以得出正确的结论。
中的实验,也可以得出正确的结论。
(评价与反思)
实验结束后,同学对实验过程进行了如下反思:如果M能够和稀酸溶液反应,探究金属![]() 铜、铝活动性顺序时,除了上述实验中已经用到的方法外,还可以根据_____进行判断
铜、铝活动性顺序时,除了上述实验中已经用到的方法外,还可以根据_____进行判断![]() 任写一种
任写一种![]() 。
。
【题目】戴口罩、勤洗手,给自己居住、生活的环境消消毒,都是预防新型冠状病毒感染的有效方法。其中“84”消毒液能用于日常生活的消毒灭菌。某化学兴趣小组对一瓶 敞口放置的“84”消毒液成分产生兴趣,在老师的指导下进行如下探究:
(提出问题)该敞口久置的“84”消毒液中含有哪些溶质?
(查阅资料)(1)“84”消毒液主要成分是次氯酸钠(NaClO)和氯化钠,NaClO 为有效成分,有腐蚀性,并易与空气中 CO2 反应(2NaClO+CO2+H2O=2HClO+Na2CO3)。
(2)次氯酸(HClO)溶液和次氯酸钠(NaClO)溶液都具有漂白、杀菌、消毒功效。
(3)HClO 不稳定,受热或光照易分解。
(提出猜想)I.“84”消毒液没有变质
II.____________
III.“84”消毒液完全变质
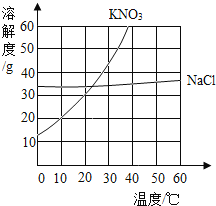
(设计方案)为验证猜想,设计如下方案:
实验操作 | 实验现象 | 结论 |
(1)另取该消毒液少量于试管中,滴加足量 BaCl2 溶液,振荡 | 产生白色沉淀 | 猜想________不成立,反应的化学方程式是____________。 |
(2)向盛有有色布条的烧杯中滴加该消毒液适量,放置一段时间 | 有色布条_________。(填“褪色”或“不褪色” | 猜想 II 不成立,猜想 III 成立 |
(得出结论)综上所述,该敞口放置的“84”消毒液中溶质一定有____________________。
(拓展延伸)
(1)次氯酸钠与盐酸反应会生成有毒的黄绿色气体单质,该气体单质是____________,因此,“84”消毒液____________________(填“能”或“不能”)与洁厕灵(主要成分为盐酸)混合使用。
(2)欲用 40%的 NaClO 溶液稀释配制 25%的溶液 400g,需要加水__________g。
【题目】对比实验是实验探究的重要方法,下列对比实验设计能实现相应实验目的的是
选项 | 实验目的 | 实验设计 | 选项 | 实验目的 | 实验设计 |
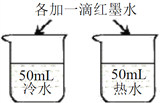
A | 探究温度对分子运动快慢的影响 |
| B | 探究水对铁钉锈蚀的影响 |
|
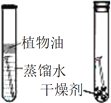
C | 探究空气是燃烧的必要条件 |
| D | 探究CO2与水反生反应 |
|
A. A B. B C. C D. D