题目内容
【题目】下列说法正确的是( )
A. 根据质量守恒定律,1g氢气和1g氧气反应生成2g水
B. 3g的碳完全燃烧后,生成了11g二氧化碳,则消耗空气8g
C. 只有固体、液体间反应遵守质量守恒定律,如果有气体参加反应,就不遵守质量守恒定律
D. 铜粉在空气中加热,反应后固体的质量增加
【答案】D
【解析】
A、氢气和氧气反应的化学方程式为:2H2+O2![]() 2H2O可知氢气和氧气反应时的质量比为1:8,故1g氢气和8g氧气反应生成9水,故A错误;
2H2O可知氢气和氧气反应时的质量比为1:8,故1g氢气和8g氧气反应生成9水,故A错误;
B、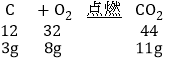
因此3g碳在空气中与8g氧气完全反应生成二氧化碳的质量为11g,而不是空气8g,故B错误;
C、任何化学反应,都遵守质量守恒定律。故C错;
D、铜粉在空气中加热后,生成物的质量比原来铜粉的质量增加,是因为铜与氧气反应生成氧化铜,属于化学变化,能用质量守恒定律解释。
故选:D。

练习册系列答案
相关题目
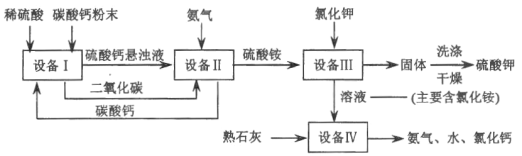
【题目】某化工厂用废硫酸制备硫酸钾的流程如下,请回答下列问题:
资料:己知20℃时硫酸铵、硫酸钾溶解度如下表:
物质 | 硫酸钾 | 氯化钾 | 氯化铵 | 硫酸铵 |
溶解度/g(20℃) | 11.1 | 34.2 | 37.2 | 75.4 |
(1)“设备I”中将碳酸钙研成粉末的目的是_____。
(2)“设备II”中发生的化学反应方程式是_____。
(3)“设备III”中发生的化学反应方程式是_____。反应物之一硫酸铵[(NH4)2SO4)]中氮元素的化合价为_____。洗涤从“设备III”中得到的固体时,不用水而是用饱和硫酸钾溶液,其目的是_____。
(4)上述流程中可循环使用的物质除水外,还有_____(填写化学式).
(5)根据本题所给的信息推断实验室_____(能、不能)用碳酸钙粉末和稀硫酸反应制备得到二氧化碳。