题目内容
【题目】氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图:
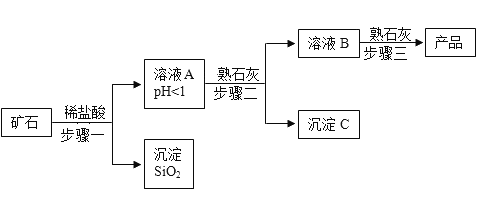
(注:在步骤二中,通过控制加入熟石灰的量,可使不同的金属离子先后生成沉淀)
(1)请写出步骤一中发生反应的化学方程式:_____(任写一个);
(2)溶液A中所含的非金属阳离子有_____(填离子符号);
(3)沉淀C的成分_____
(4)三个步骤中均用到的玻璃仪器是_____、_____、_____;
(5)步骤三中生成产品的化学方程式为_____。
【答案】MgO+2HCl=MgCl2+H2O或Fe2O3+6HCl=2FeCl3+3H2O或CuO+2HCl=CuCl2+H2O H+ 氢氧化铜和氢氧化铁 烧杯 漏斗 玻璃棒 MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2
【解析】
(1)步骤一中发生三个反应:氧化镁与盐酸反应生成氯化镁和水,氧化铁与盐酸反应生成氧化铁和水,氧化铜与水反应生成氯化铜和水,故反应的化学方程式写为:MgO+2HCl=MgCl2+H2O或Fe2O3+6HCl=2FeCl3+3H2O或CuO+2HCl=CuCl2+2H2O。
(2)溶液A的pH<1,所以溶液中有盐酸剩余,则溶液中的溶质有盐酸、氯化镁、氯化铁和氯化铜,则溶液A中所含的非金属阳离子是氢离子,氢离子带一个单位的正电荷,其符号为H+,故填H+。
(3)在酸性溶液中加入氢氧化钙后,活动性弱的金属盐溶液先与碱溶液反应,所以沉淀C中有氯化铜,氯化铜分别与熟石灰生成的氢氧化铜和氢氧化铁,故填氢氧化铜和氢氧化铁。
(4)三个步骤均将沉淀与液体进行分离,操作为过滤,用到的玻璃仪器是烧杯、漏斗和玻璃棒,故填烧杯、漏斗和玻璃棒。
(5)步骤三中的反应是氯化镁与氢氧化钙反应生成氢氧化镁沉淀和氯化钙,故反应的化学方程式写为:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2。

 海淀黄冈名师导航系列答案
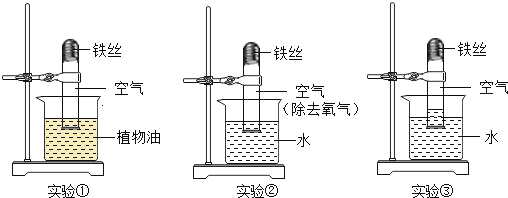
海淀黄冈名师导航系列答案【题目】为探究CO2与NaOH溶液发生的反应,某兴趣小组尝试用不同的方式进行实验。
(查阅资料)
20℃时,几种物质在水中的溶解度见表:
物质 | Na2CO3 | NaHCO3 | Ca(OH)2 | Ba(OH)2 |
溶解度/g | 21.5 | 9.6 | 0.165 | 3.89 |
(实验探究)
(1)实验一:小雨取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪,小雨另取一相同的充满CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是_____。
(2)实验二:为检验CO2与NaOH溶液反应的产物,小亮取实验一所得溶液X少许,向其中滴加BaCl2溶液,有白色沉淀产生,该反应的化学方程式为_____。实验中不宜将BaCl2溶液换成CaCl2溶液的原因是_____。
(3)实验三:小华取实验一所得溶液X少许,向其中加入过量的BaCl2溶液,振荡,静置,取上层清液,滴入1滴酚酞试液,发现溶液呈_____色,证明溶液X中有NaOH剩余。实验中,小华没有直接向少量溶液X中滴入酚酞试液,理由是_____。
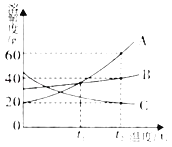
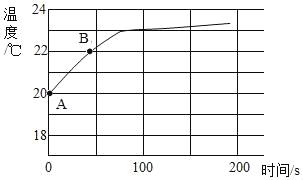
(4)实验四:兴趣小组将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中温度变化,结果如图所示。图中,AB段温度变化的原因是_____。
(反思感悟)
(5)实验从CO2减少、NaOH减少、Na2CO3生成等物质的变化,以及_____转化等视角多维度探究CO2与NaOH发生了反应,对于现象不明显的化学反应,可以通过现代技术手段进行数据测定,实现反应过程的“可视化”。
【题目】某化学兴趣小组对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究。请你参与他们的探究活动,并回答有关问题。已知:①氯化钠溶液显中性②氯化铜易溶于水
(实验探究)
(1)方案一:某同学先向试管中加入约2mLNaOH溶液,再滴入几滴酚酞溶液,溶液变红。然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为无色,证明NaOH溶液与稀盐酸恰好完全反应。
①从微观的角度分析,该反应的实质是_____。
②在滴入稀盐酸的过程中,若观察到曾有少量气泡出现,请分析产生气泡的原因可能是_____(写出一条即可)。
(2)方案二:
实验步骤 | 实验现象 | 结论 |
取2mLNaOH溶液于 试管中,滴入一定量 的稀盐酸,振荡后加 入镁条 | 若_____ | 稀盐酸过量 |
若没有明显现象 | NaOH溶液与稀盐酸恰好完全反应 |
(实验反思)
(3)有同学提出方案二不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是_____。
(4)除以上方案外,下列哪些物质单独使用也能完成该实验?_____(填序号)。
ApH试纸 B铜 C紫色石蕊试液 D硫酸铜