题目内容
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂。下图是工业上用印刷电路的蚀刻液的废液(含FeCl3、CuCl2、FeCl2)生产CuCl的流程并制得FeCl3蚀刻液。
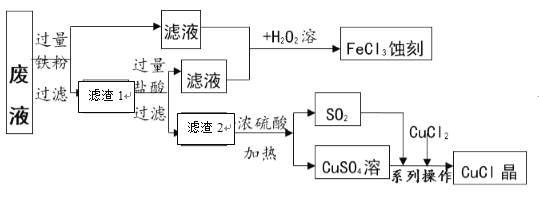
[资料] (1)氯化亚铜是一种白色晶体,微溶于水、不溶于乙醇及稀硫酸;
(2)2FeCl3+Fe = 3FeCl2按要求回答下列问题:
(1)废液中加入铁粉时,发生置换反应的化学方程式为____________;滤渣2的成分是_____________。
(2)滤液1、2合并后与过氧化氢溶液反应的化学方程式为___________________。
(3)上述流程中生成CuCl的化学方程式为:SO2 + CuSO4 + CuCl2+ 2H2O ===2CuCl↓+2X,则X的化学式为____________。分离、提纯CuCl晶体过程中的“系列操作”包括“调pH、过滤、洗涤、低温烘干”。为得到纯净的CuCl晶体,可用下列____________ (填字母序号)进行洗涤。
a.纯净水 b.乙醇 c.稀硫酸 d.氯化铜溶液
【答案】CuCl2+Fe== FeCl2+Cu Cu 2FeCl2+H2O2+2HCl= 2FeCl3 +2H2O H2SO4 b
【解析】
(1)废液中加入过量的铁粉时,氯化铜与铁反应生成铜和氯化亚铁,发生置换反应的化学方程式为CuCl2+Fe== FeCl2+Cu;滤渣2的成分是铜;
(2)滤液1、2合并后与过氧化氢溶液反应的化学方程式为2FeCl2+H2O2+2HCl= 2FeCl3 +2H2O;
(3)上述流程中生成CuCl的化学方程式为:SO2 + CuSO4 + CuCl2+ 2H2O ===2CuCl↓+2X,根据化学反应前后原子的种类和数目不变,则X的化学式为H2SO4;氯化亚铜是一种白色晶体,微溶于水、不溶于乙醇及稀硫酸;为得到纯净的CuCl晶体,可用乙醇进行洗涤,不能用稀硫酸,因为硫酸中的氢离子和硫酸根离子会附着在氯化亚铜表面。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案【题目】为了测定某地石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行如下实验:(请写出详细的计算过程)
实验 | 1 | 2 | 3 | 4 |
加入样品的质量(g) | 5 | 10 | 15 | 20 |
生成CO2的质量(g) | 1.76 | 3.52 | 4.4 | 4.4 |
(1)计算这种石灰石样品中碳酸钙的质量分数___.
(2)计算出实验所用稀盐酸中HCl的质量分数___.