题目内容
【题目】某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10克样品放入烧杯中,再取60克稀硫酸分六次加入烧杯中,俊充分反应,实验数据如下:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 | |
加入稀硫酸的质量(g) | 10 | 10 | 10 | 10 | 10 | 10 |
剩余固体的质量(g) | 9.35 | 8.7 | 8.05 | 7.4 | 6.75 | 6.75 |
求:(1)黄铜样品中锌的质量分数____;(写出计算步骤,下同)
(2)完全反应后产生氢气的质量_____;
(3)所用稀硫酸的质量分数____。
【答案】32.5% 0.1g 9.8%
【解析】
(1)锌的质量为:10g-6.75g=3.25g,
黄铜样品中锌的质量分数为:![]() ×100%=32.5%,
×100%=32.5%,
答:黄铜样品中锌的质量分数是32.5%.
(2)设生成氢气的质量为x,稀硫酸中溶质质量为y
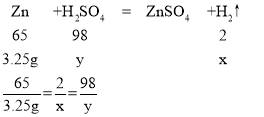
X=0.1g y=4.9g
答:反应过程中产生氢气的质量是0.1g.
(3)稀硫酸中溶质质量分数为![]() ×100%=9.8%
×100%=9.8%
答:所用稀硫酸的质量分数为9.8%。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
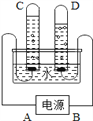
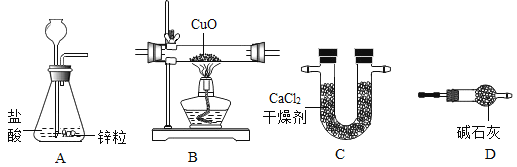
新课标快乐提优暑假作业陕西旅游出版社系列答案【题目】利用干燥而纯净的氢气还原氧化铜的实验测定水的质量组成。其装置如下图所示:完全反应后其实验测定的数据如下表所列(必要时装置可重复使用)。
实验前 | 实验后 | |
(氧化铜+玻璃管)的质量/g | 75.6 | 69.2 |
(氯化钙+U型管)的质量/g | 100.8 | 118.0 |
试回答:
(1)A中反应容器的仪器名称是:__________。
(2)装置正确的连接顺序(自左向右)是(填字母)A-________--________--________--________。
(3)连接好装置并检查气密性装好药品后在加热前的必要操作是:________。
(4)生成水中氢元素的质量为________________________。
(5)如果没有实验装置D,实验测得水中氢的质量________(填“偏大”“偏小”或者“不变”)。
(6)本实验装置从安全角度考虑存在的缺陷是:________________________。