题目内容
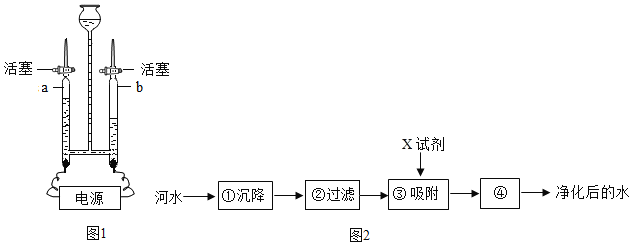
【题目】下图是电解水的装置。
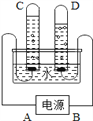
①写出电解水的化学反应方程式____________________。
②试管D中收集的气体是_____,A是电源的_____极。
③该反应开始时,可观察到电极上_______________。
④理论上生成气体的体积比V(C)∶V(D)=________。
⑤原子是化学变化中的最小微粒,若a→c→b可表示一种化合反应,那表示分解反应的顺序应该是_________。

⑥运用分与合的思想都能证明水是由氢元素和氧元素组成的化合物,请写出能证明水是由氢元素和氧元素组成的化合反应方程式___________________________。
【答案】2H2O![]() 2H2↑ + O2↑ 氢气 正 产生大量气泡 1:2 b→c→a 2H2 + O2
2H2↑ + O2↑ 氢气 正 产生大量气泡 1:2 b→c→a 2H2 + O2 ![]() 2H2O
2H2O
【解析】
①该反应的化学方程式2H2O![]() 2H2↑ + O2↑;②与正极相连的试管生成的气体是氧气,较少;与负极相连的试管生成的是氢气,较多,氢气的体积是氧气体积的2倍;③该反应开始时,可观察到电极上产生大量气泡;④与正极相连的试管生成的气体是氧气,较少;与负极相连的试管生成的是氢气,较多,氢气的体积是氧气体积的2倍;所以V(C)∶V(D)=1:2;⑤化合反应是多种物质反应生成另一种物质,分析图可知反应的顺序为:b→c→a;⑥能够证明水由氢元素和氧元素组成的化合反应是氢气在氧气中燃烧生成水,反应方程式为:2H2 + O2
2H2↑ + O2↑;②与正极相连的试管生成的气体是氧气,较少;与负极相连的试管生成的是氢气,较多,氢气的体积是氧气体积的2倍;③该反应开始时,可观察到电极上产生大量气泡;④与正极相连的试管生成的气体是氧气,较少;与负极相连的试管生成的是氢气,较多,氢气的体积是氧气体积的2倍;所以V(C)∶V(D)=1:2;⑤化合反应是多种物质反应生成另一种物质,分析图可知反应的顺序为:b→c→a;⑥能够证明水由氢元素和氧元素组成的化合反应是氢气在氧气中燃烧生成水,反应方程式为:2H2 + O2 ![]() 2H2O。
2H2O。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案【题目】某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10克样品放入烧杯中,再取60克稀硫酸分六次加入烧杯中,俊充分反应,实验数据如下:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 | |
加入稀硫酸的质量(g) | 10 | 10 | 10 | 10 | 10 | 10 |
剩余固体的质量(g) | 9.35 | 8.7 | 8.05 | 7.4 | 6.75 | 6.75 |
求:(1)黄铜样品中锌的质量分数____;(写出计算步骤,下同)
(2)完全反应后产生氢气的质量_____;
(3)所用稀硫酸的质量分数____。
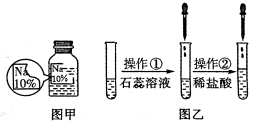
【题目】(7分)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
【猜想与假设】其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
【资料查阅】上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
【探究过程】
如图乙所示,在操作①后可确定溶质不是NaCl,则其实验现象应是 ;
在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的 。
【探究结论】
你认为该溶液中的溶质可能是上述假设物质中的 ,你的判断依据是 。
【探究反思】
(1)若上述探究结论是正确的,操作②产生的气体应是 (写化学式),实验室检验该气体的实验操作及现象是 。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由: 。