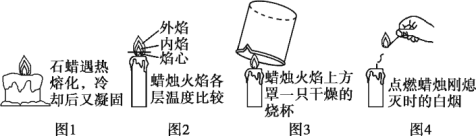
题目内容
【题目】实验室常用下列装置研究气体的制取和性质,根据所学知识回答下列问题.
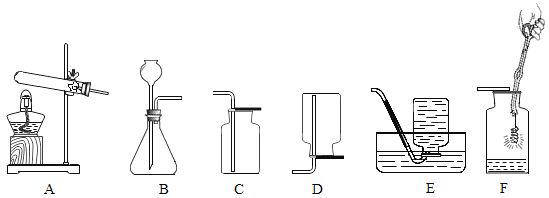
(1)写出实验室制取氧气的一个化学方程式______.利用该反应制取氧气,发生装置应选(填序号)______,
(2)一氧化氮气体难溶于水,在空气中容易发生下列反应2NO+O2═2NO2,则收集一氧化氮气体时应该用的装置是______(填序号).
【答案】2H2O2![]() 2H2O+O2↑等 B(采用的加热高锰酸钾或氯酸钾的方法,装置为A) E
2H2O+O2↑等 B(采用的加热高锰酸钾或氯酸钾的方法,装置为A) E
【解析】
(1)在实验室中可以采用分解过氧化氢溶液、加热氯酸钾或加热高锰酸钾的方法制取氧气,据此进行分析解答;
(2)一氧化氮气体难溶于水,在空气中容易发生下列反应![]() ,据此进行分析解答。
,据此进行分析解答。
(1)在实验室中可以采用分解过氧化氢溶液、加热氯酸钾或加热高锰酸钾的方法制取氧气,如过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为: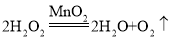 (合理即可);利用该反应制取氧气,属于固-液常温型,发生装置应选B。
(合理即可);利用该反应制取氧气,属于固-液常温型,发生装置应选B。
(2)一氧化氮气体难溶于水,能用排水法收集;在空气中容易发生下列反应![]() ,不能用排空气法收集,故收集一氧化氮气体时应该用的装置是E。
,不能用排空气法收集,故收集一氧化氮气体时应该用的装置是E。
故答案为:(1)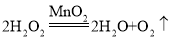 (合理即可);B(采用的加热高锰酸钾或氯酸钾的方法,装置为A);(2)E。
(合理即可);B(采用的加热高锰酸钾或氯酸钾的方法,装置为A);(2)E。

【题目】某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10克样品放入烧杯中,再取60克稀硫酸分六次加入烧杯中,俊充分反应,实验数据如下:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 | |
加入稀硫酸的质量(g) | 10 | 10 | 10 | 10 | 10 | 10 |
剩余固体的质量(g) | 9.35 | 8.7 | 8.05 | 7.4 | 6.75 | 6.75 |
求:(1)黄铜样品中锌的质量分数____;(写出计算步骤,下同)
(2)完全反应后产生氢气的质量_____;
(3)所用稀硫酸的质量分数____。
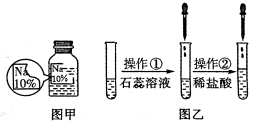
【题目】(7分)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
【猜想与假设】其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
【资料查阅】上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
【探究过程】
如图乙所示,在操作①后可确定溶质不是NaCl,则其实验现象应是 ;
在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的 。
【探究结论】
你认为该溶液中的溶质可能是上述假设物质中的 ,你的判断依据是 。
【探究反思】
(1)若上述探究结论是正确的,操作②产生的气体应是 (写化学式),实验室检验该气体的实验操作及现象是 。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由: 。
【题目】小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中碳酸钙的质量分数进行检测,采用的办法如下:取用8 g这种石灰石样品,把40 g稀盐酸分4次加入,测量过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应)。请计算:
序号 | 加入稀盐酸质量/g | 剩余固体质量/g |
第1次 | 10 | 5.5 |
第2次 | 10 | m |
第3次 | 10 | 1.2 |
第4次 | 10 | 1.2 |
(1)下表中m的数值应该为_________ ?
(2)样品中碳酸钙的质量分数是____________?