题目内容
【题目】碳酸氢钠是生活中常见的一种盐,在生活中用途广泛。小明和小红设计实验对碳酸氢钠的性质进行了探究,请你参与他的探究活动。
(探究实验1)碳酸氢钠溶液的酸碱性
(实验方案)取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞试液,振荡。
现象:溶液变成浅红色。小红则用玻璃棒蘸取碳酸氢钠溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出该溶液的pH_____(填“<”“>”“=”)7。
(探究实验2)与酸的反应
(实验方案)取少量该固体加入试管中,滴加稀盐酸;现象_____,反应的化学方程式为_____。
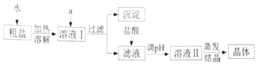
(探究实验3)碳酸氢钠的热稳定性
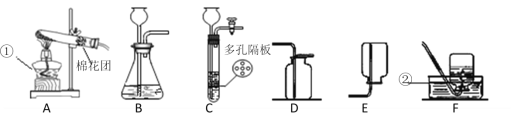
(实验方案)设计实验装置如图,并进行实验。

现象:试管口有水珠出现,澄清石灰水变浑浊,充分加热后,试管中留下白色固体。
结论:碳酸氢钠受热有二氧化碳、水和白色固体生成。
请你帮小明设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH(所选试剂不能用酸)
实验步骤_____。
实验现象_____。
有关反应的化学方程式_____。
【答案】> 固体溶解,产生气泡 NaHCO3+HCl═NaCl+H2O+CO2↑ 取适量白色固体于试管中,加入足量水溶解,滴加氢氧化钙溶液 产生白色沉淀 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
【解析】
显碱性溶液能使酚酞试液变红色,pH大于7;
碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,受热分解生成碳酸钠、水和二氧化碳,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠。
【1实验方案】
取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞试液,振荡,溶液变成浅红色,说明溶液显碱性;小红则用玻璃棒蘸取碳酸氢钠溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出该溶液的pH>7,说明溶液显碱性。
故答案:>。
【2实验方案】
取少量该固体加入试管中,滴加稀盐酸,固体溶解,产生气泡,是因为碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑。
故答案:固体溶解,产生气泡;NaHCO3+HCl═NaCl+H2O+CO2↑。
证明试管中留下的白色固体是Na2CO3,而不是NaOH的实验方案:
实验步骤:取适量白色固体于试管中,加入足量水溶解,滴加氢氧化钙溶液;
实验现象:产生白色沉淀;
产生白色沉淀,是因为碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式:![]() 。
。
故答案:取适量白色固体于试管中,加入足量水溶解,滴加氢氧化钙溶液;产生白色沉淀;![]() 。
。

【题目】化学兴趣小组的同学为了探究中和反应,取一定量氢氧化钠溶液于烧杯中,向其中加入一定量稀硫酸,发现无明显现象。为验证中和反应确实能够发生,他们将烧杯中溶液分成三份,甲、乙、丙三名同学分别进行以下实验。观察到甲中为红色,乙中无明显现象,丙中有白色沉淀生成。请回答下列问题。

(1)甲、乙、丙三个实验中能证明氢氧化钠与硫酸确实发生反应的是___。
(2)经分析,烧杯中的反应发生后,溶液中溶质成分为___。
(3)实验后,甲、乙、丙同学将三支试管中的废液全部倒入同一洁净烧杯中,静止一段时间后,过滤。向滤渣中加入过量稀硝酸,沉淀部分溶解,则滤渣中一定含有的物质是___。
(4)同学们又对滤液中溶质成分进行探究。滤液中溶质成分除酚酞外,一定还含有的溶质是___,可能含有的溶质有以下四种情况:
猜想一:只有硫酸钠
猜想二:____
猜想三:___
猜想四:只有氯化钡。
为了验证以上猜想哪一种正确,同学们进行实验继续探究,最终得出正确结论。请完成以下探究。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
取样于试管中,先滴加足量__再滴加氯化钡溶液。 | 溶液由红色变为无色,___ 有白色沉淀生成 | 猜想一正确 |