题目内容
【题目】溶液在生活中应用非常广泛,因而了解溶液的有关知识非常必要。
(1)下图甲为X、Y、Z三种固体物质的溶解度曲线,根据曲线可知30oC时X的溶解度为_______g。小明同学欲在40oC时配制100g 25%的Y物质的溶液,他_______(填“能”或“不能”)达到目的。
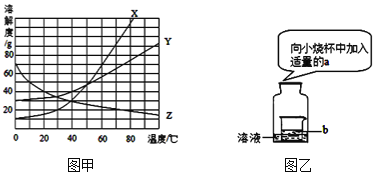
(2)小丽用图乙所示装置进行实验。
①若广口瓶内盛有70 g X物质的不饱和溶液, b是水,a是下列________(填字母)物质,有望变成饱和溶液。
A.浓硫酸 B.硝酸铵 C.氢氧化钠 D.氧化钙
②若广口瓶内盛有10gZ物质的饱和溶液,a、b分别是镁条和稀硫酸,观察到的现象是(Z与其他物质不反应)______________________________________________________。
【答案】 20 不能 B 小烧杯内有大量气泡产生,镁条逐渐减少以至消失,广口瓶内出现浑浊现象
【解析】本题考查了固体溶解度曲线应用,溶解时的吸热或放热现象,物质发生化学变化时的能量变化。
(1)根据溶解度曲线可知,30℃时X的溶解度为20g;40℃时,Y的溶解度为40g,其饱和溶液中溶质的质量分数为![]() ×100%=28.6%,25%<28.6%,能配制100克25%的Y物质的溶液;
×100%=28.6%,25%<28.6%,能配制100克25%的Y物质的溶液;
(2)X的溶解度随着温度的升高而增大,使70gX物质的不饱和溶液变成饱和溶液可以采取降温的方法,硝酸铵溶于水温度降低,故选B;
(3)镁条和稀硫酸反应有气泡产生,放出大量的热, Z的溶解度随着温度的升高而减小,Z物质的饱和溶液,升温后有晶体析出,溶液变浑浊。所以观察到的现象是小烧杯内有大量气泡产生,镁条逐渐减少以至消失,广口瓶内出现浑浊现象。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目