题目内容
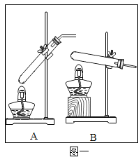
【题目】仔细观察实验装置图,回答相关问题。
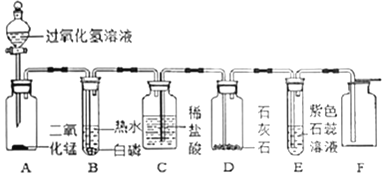
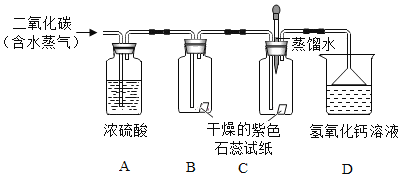
![]() 打开分液漏斗的活塞放出一定量过氧化氢溶液后,关上活塞,A中出现大量气泡,反应的化学方程式______。
打开分液漏斗的活塞放出一定量过氧化氢溶液后,关上活塞,A中出现大量气泡,反应的化学方程式______。
![]() 装置B中发生的现象说明燃烧的条件是______,反应的化学方程______。
装置B中发生的现象说明燃烧的条件是______,反应的化学方程______。
![]() 中液面下降,稀盐酸沿导管流入D瓶中,C中稀盐酸能流入D中的原因是______,写出D中反应的化学方程式______。
中液面下降,稀盐酸沿导管流入D瓶中,C中稀盐酸能流入D中的原因是______,写出D中反应的化学方程式______。
![]() 中紫色石蕊溶液变红的原因是______,反应的化学方程式______。
中紫色石蕊溶液变红的原因是______,反应的化学方程式______。
![]() 验证F装置气体收集满的方法是______。
验证F装置气体收集满的方法是______。
![]() 装置除用于实验室制取氧气外,还可用于氢气等气体的制取,用此装置制取气体的优点是______。
装置除用于实验室制取氧气外,还可用于氢气等气体的制取,用此装置制取气体的优点是______。
【答案】2H2O2![]() 2H2O+O2
2H2O+O2![]() 与氧气接触 4P+5O2
与氧气接触 4P+5O2![]() 2P2O5 氧气进入C瓶,瓶内压强增大
2P2O5 氧气进入C瓶,瓶内压强增大 ![]() 二氧化碳与水化合生成了碳酸,碳酸能使紫色的石蕊试液变成红色
二氧化碳与水化合生成了碳酸,碳酸能使紫色的石蕊试液变成红色 ![]() 将燃着的木条放在F瓶口,若熄灭,则收集满了 可控制反应的速率
将燃着的木条放在F瓶口,若熄灭,则收集满了 可控制反应的速率
【解析】
![]() 由题意知,反应物双氧水,生成物水和氧气,反应条件为二氧化锰作催化剂,故A中发生反应的化学方程式为2H2O2
由题意知,反应物双氧水,生成物水和氧气,反应条件为二氧化锰作催化剂,故A中发生反应的化学方程式为2H2O2![]() 2H2O+O2
2H2O+O2![]() ;故填:2H2O2
;故填:2H2O2![]() 2H2O+O2
2H2O+O2![]()
![]() 中白磷能够燃烧的原因是白磷的温度达到着火点,与氧气接触;磷与氧气在点燃的条件下反应生成五氧化二磷;故填:与氧气接触;4P+5O2
中白磷能够燃烧的原因是白磷的温度达到着火点,与氧气接触;磷与氧气在点燃的条件下反应生成五氧化二磷;故填:与氧气接触;4P+5O2![]() 2P2O5
2P2O5
![]() 由图示可知,氧气流进入C,则把盐酸压入D和石灰石反应生成二氧化碳;故填:氧气进入C瓶,瓶内压强增大;
由图示可知,氧气流进入C,则把盐酸压入D和石灰石反应生成二氧化碳;故填:氧气进入C瓶,瓶内压强增大;![]() ;
;
![]() 由于二氧化碳与水化合生成了碳酸,碳酸能使紫色的石蕊试液变成红色,所以E中紫色石蕊溶液变红;故填:二氧化碳与水化合生成了碳酸,碳酸能使紫色的石蕊试液变成红色;
由于二氧化碳与水化合生成了碳酸,碳酸能使紫色的石蕊试液变成红色,所以E中紫色石蕊溶液变红;故填:二氧化碳与水化合生成了碳酸,碳酸能使紫色的石蕊试液变成红色;![]() ;
;
![]() 由于二氧化碳不燃烧不支持燃烧,所以验证F装置气体收集满的方法是:将燃着的木条放在F瓶口,若熄灭,则收集满了;故填:将燃着的木条放在F瓶口,若熄灭,则收集满了;
由于二氧化碳不燃烧不支持燃烧,所以验证F装置气体收集满的方法是:将燃着的木条放在F瓶口,若熄灭,则收集满了;故填:将燃着的木条放在F瓶口,若熄灭,则收集满了;
![]() 由于分液漏斗能控制加入液体的量,所以用此装置制取气体的优点是可控制反应的速率;故填:可控制反应的速率。
由于分液漏斗能控制加入液体的量,所以用此装置制取气体的优点是可控制反应的速率;故填:可控制反应的速率。

【题目】硫酸(H2SO4)是一种用途广泛的化工原料,工业上常用煅烧黄铁矿(主要成分是FeS2)的方法来生产硫酸,简要的工艺流程图如下:
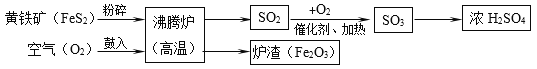
(1)黄铁矿投入沸腾炉前粉碎的目的是________。
(2)在沸腾炉中发生的反应为:(______)FeS2+(______)O2 ![]() (______)Fe2O3+(______)SO2(请在化学式前面配上适当的化学计量数),得到的炉渣(Fe2O3)可用来炼铁。
(______)Fe2O3+(______)SO2(请在化学式前面配上适当的化学计量数),得到的炉渣(Fe2O3)可用来炼铁。
(3)请写出流程中SO2转化为SO3的化学方程式_________。
(炉渣的综合利用)
为了实现炉渣(Fe2O3)的综合利用,工业上把炉渣和焦炭、石灰石一起投入高炉,主要反应过程如图:
![]()
(4)步骤②发生反应的化学方程式为______。
(5)下列有关高炉炼铁的说法正确的是_______(填序号)。
A.上述流程中涉及的三个反应均为吸热反应
B.上述步骤①反应中,还原剂是焦炭
C.焦炭的作用之一是为炼铁炉提供高温条件
D.焦炭的另一个作用是除去铁矿石中的杂质
(6)分析高炉所得的生铁中单质铁的含量:
小瑾同学为测定生铁中铁的质量分数,先后进行了四次实验,实验数据记录如下表。根据她的实验数据,试计算生铁中铁的质量分数是_________?
第一次 | 第二次 | 第三次 | 第四次 | |
所取生铁的质量∕g | 10 | 10 | 10 | 10 |
所加稀硫酸的质量∕g | 25 | 50 | 75 | 100 |
生成氢气的质量∕g | 0.10 | 0.20 | 0.30 | 0.35 |
(反思质疑)
小宇同学在梳理工业炼铁的相关知识时,提出了以下质疑:
(质疑一)焦炭也具有还原性而且成本低,工业炼铁为什么不直接用焦炭作为还原剂冶炼铁矿石?
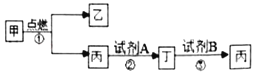
(7)他设计了下图所示的一组对比实验:称取两份相同质量的氧化铁粉末,一份与足量的焦炭粉末混合均匀放入装置A的试管中,另一份放入装置B的玻璃管中。
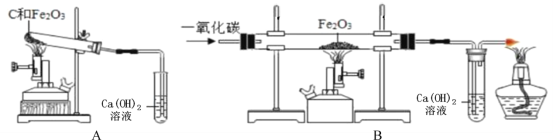
①装置B的玻璃管中发生反应的化学方程式为________。
②当他观察到装置B的玻璃管中固体_________、澄清石灰水变浑浊时,装置A
③通过上述实验对比,小宇同学认为工业上不直接用焦炭作为还原剂炼铁的主要原因有:反应不充分、反应速度慢、_______等。
(质疑二)装置B中反应后的黑色固体一定就是单质铁吗?
(查阅资料)
a.铁常见的氧化物有氧化铁(Fe2O3)、四氧化三铁(Fe3O4)和氧化亚铁(FeO)。
b.四氧化三铁是具有磁性的黑色晶体,氧化亚铁是不溶于水的黑色粉末,无磁性,也不能被磁铁吸引。
④小宇同学设计了如下实验方案:用磁铁吸引装置B进行实验后的黑色固体,发现黑色固体可以部分被吸引,由此得出结论:黑色固体的成分是___________。