��Ŀ����
����Ŀ��Ϊ�˽����ķֽ���ʵ��С�����������̽����
���������ϡ����ᣨHCOOH�����۵�Ϊ8.6�����ֽܷ������������ʡ�
��������롿ʵ��С��Լ���ķֽ��������˲��룺
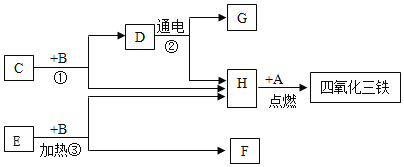
����1��H2��CO2������2��CO��H2O��
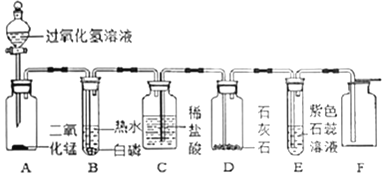
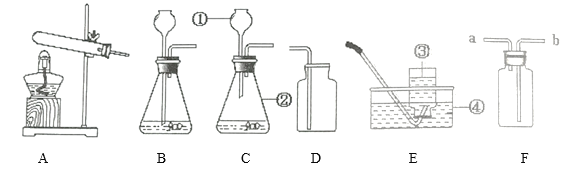
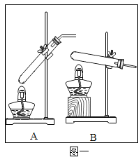
�����ʵ�顿20��ʱ�������״̬Ϊ______����ͼһװ����ѡ����ʵ�װ��______������ţ��Լ�����м��ȡ�Ϊ�˼ӿ�ֽ����ʣ�ʵ��С������˴�������Ӧ�ֽ����ͨ��ͼ��װ�ý���ʵ�顣
��ʵ��Ԥ�⡿������l��������D�е�ʵ������ӦΪ______��
������ʵ�顿ʵ���й۲쵽C��ƿ�ڳ��ִ���ˮ�飬F���������г��ֵ�����Ϊ______������ֽ�Ļ�ѧ����ʽΪ______��
��������չ�����ϱ�������ͬ�����£�����ķֽ���ﲻͬ������1�Ͳ���2���ܳ������ݴ�С�¶Լ���ķֽ����������²��룺����3��H2O��CO2������4.CO��H2����������Ϊ�������ʵ�����ȷ������3�Ͳ���4������������______��
���𰸡������ʵ�顿Һ̬��A����ʵ��Ԥ�⡿��Һ��죻������ʵ�顿��ɫ���ʱ�ɺ�ɫ��HCOOH![]() CO+H2O��
CO+H2O��
��������չ�������������غ㶨������Ӧǰ��ԭ����Ŀ����ȣ�
�������������ʵ�顿���ݼ��ᣨHCOOH�����۵�Ϊ8.6����֪��20��ʱ�������״̬ΪҺ̬�����ڼ����״̬ΪҺ̬�����Թ�Ӧ������б����Ӧѡ��װ��A��
��ʵ��Ԥ�⡿������l������������к��ж�����̼����D������ɫʯ����Һ����D�е�ʵ������ӦΪ��Һ��죻
������ʵ�顿ʵ���й۲쵽C��ƿ�ڳ��ִ���ˮ�飬˵����ˮ���ɣ���һ��˵������2������F��������������ͭ��������Ӧ����ɫ���������ɺ�ɫ��������F���������г��ֵ�����Ϊ����ɫ���ʱ�ɺ�ɫ������ֽ�Ļ�ѧ����ʽΪHCOOH![]() CO+H2O��
CO+H2O��
��������չ����������Ϊ�������ʵ�����ȷ������3�Ͳ���4�����������ǣ������������غ㶨������Ӧǰ��ԭ����Ŀ����ȣ���