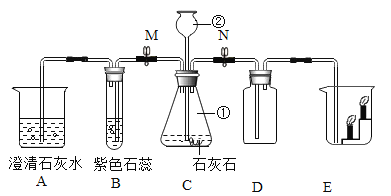
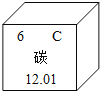
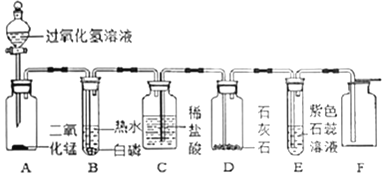
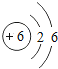题目内容
【题目】为测定黄铜(Cu﹣Zn合金)中铜的质量分数,某同学将20g该合金放入到盛有100g盐酸的烧杯中,锌与盐酸恰好完全反应。反应停止后,测得烧杯中剩余物的总质量为119.8g。
(1)生成氢气的质量为_____;
(2)计算合金中锌的质量_____;(写出计算过程)
(3)计算合金中铜的质量分数_____;(写出计算过程,精确到0.1%);
(4)计算盐酸中溶质的质量分数_____。(写出计算过程,精确到0.1%)。
【答案】0.2g 6.5g 67.5% 7.3%
【解析】
根据质量守恒定律可得,生成的氢气的质量为20g+100g﹣119.8g=0.2g
设锌的质量为x。稀盐酸中溶质的质量分数为y
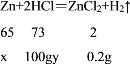
![]() =
=![]() =
=![]()
x=6.5g
y=7.3%
合金中铜的质量分数为![]() ×100%=67.5%
×100%=67.5%
答:(1)生成氢气的质量为 0.2g;
(2)合金中锌的质量为6.5g;
(3)合金中铜的质量分数为67.5%;
(4)盐酸中溶质的质量分数为7.3%。

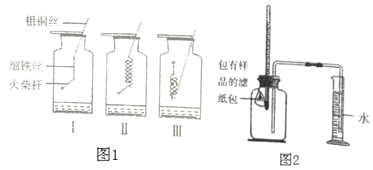
【题目】世界上每年因锈蚀而报废的金属设备和材料,高达产量的20%~40%,某实验小组对铁的燃烧和锈蚀进行了如下探究。
(探究一:铁丝燃烧)如图1所示,取三根粗细、长度均相同的光亮细铁丝,将其中两根盘成螺旋状。在每根铁丝一端系上一根粗铜丝,另一端系一根火柴杆。点燃火柴杆,待快燃尽时,分别插入盛有氧气的集气瓶中。观察到:Ⅰ和Ⅱ中的铁丝都剧烈燃烧,且Ⅱ中铁丝燃烧比I中更剧烈,Ⅲ中铁丝没有燃烧。
(1)集气瓶中装少量水的作用______。
(2)Ⅱ中铁丝燃烧比I中更剧烈的原因是______。
(3)Ⅲ中铁丝没有燃烧是因为______。
(探究二:铁粉腐蚀的条件)如图2所示,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,观察到量筒内的水沿着导管慢慢进入广口瓶(容积为146mL)。当温度恢复到室温,量筒内水面高度不变时读数(此时广口瓶内氧气含量几乎为零),记录量筒内的起始和最终读数以及所需时间如下表:
序号 | 样品 | 量简起始读数 | 量简最后读数 | 所需时间 |
|
| 100 | 72 | 约120 |
| 10g铁粉、 | 100 | 72 | 约70 |
|
(4)金属锈蚀是金属与______发生了反应。
(5)实验①和②说明NaCl可以______(填“加快”或“减慢”)铁锈蚀的过程
(6)span>实验开始后,广口瓶温度升高,说明铁锈蚀是______(填“吸热”或“放热”)的过程。
(7)实验①和实验③是探究碳对铁锈蚀速率的影响,实验③表格的空白处样品的组成是______。
(8)该装置还可用于测量空气中氧气的含量,根据上述数据计算出空气中氧气的体积分数是______%(精确到小数点后一位),试分析实验结果出现误差的原因是______(写出一条即可)。