题目内容
【题目】向一定质量含CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10%的Na2CO3溶液,反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示,下列说法不正确的是( )

A. 图中Oa段表示产生气体的过程且X的值为53
B. 图中Xb段表示产生沉淀的过程且Y值为63.6
C. c点时,溶液的pH>7
D. b点时,溶液中的溶质有1种
【答案】B
【解析】
加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀,最后到达最高点说明已经反应完了。
解:图中oa段表示生成的气体质量,设与盐酸反应的碳酸钠的质量为x,
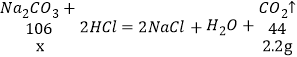
![]()
x=5.3g
X=![]() =53g,故与盐酸反应的碳酸钠溶液为53g。
=53g,故与盐酸反应的碳酸钠溶液为53g。
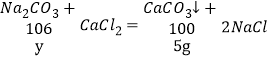
![]()
y=5.3g;
Y=![]() =106g。
=106g。
A、图中Oa段表示产生气体的过程且X的值为53,不符合题意;
B、图中Xb段表示产生沉淀的过程且Y值为106g,符合题意;
C、c点时,碳酸钠溶液过量,溶液中溶质为氯化钠、碳酸钠,所以溶液的pH>7,不符合题意;
D、b点时,溶液中的溶质有氯化钠1种,不符合题意。故选B。

练习册系列答案
相关题目
【题目】菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中MgCO3的含量,学习小组进行了实验研究.取10克菱镁矿样品,向其中逐滴加入未知质量分数的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如表:
加入H2SO4溶液的质量/g | 50 | 100 | 150 | 200 |
NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
(假设菱镁矿中的杂质不溶于水,不与酸发生反应.)
(1)10克菱镁矿与H2SO4溶液完全反应,生成CO2的质量为_____.
(2)该菱镁矿中MgCO3的质量分数是多少?____
(3)该实验研究中所用H2SO4溶液的溶质质量分数是多少?____