��Ŀ����
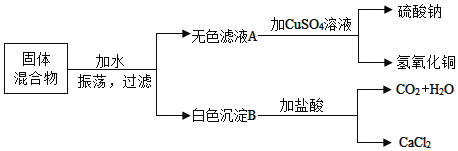
����Ŀ��KNO3 ���ƺڻ�ҩ����Ҫԭ�ϡ�
��KNO3 ���� ________������������������������������
��KNO3 ������ɫ��Ӧ������ɫ�ܲ����۲쵽�����________ɫ��
���±��� KNO3 �ڲ�ͬ�¶�ʱ���ܽ�ȡ�
�¶ȣ��棩 | 30 | 40 | 50 | 60 | 70 | 80 |
�ܽ�ȣ�g/100g ˮ�� | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
I. 30��ʱ��KNO3 ���ܽ����________g/100g ˮ��
II. 50��ʱ��KNO3 ��Һ�����������������ֵ��_________��ֻ�г�����ʽ����
III. 80��ʱ����һ�������� KNO3 ��Һ��ͼʾ���в�����
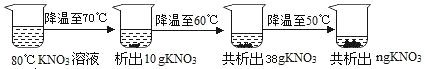
80��ʱ�� KNO3 ��Һ��________����������������������������Һ��ͼ�� n ����ֵΪ________��
���𰸡��� �� 45.8�� ![]() ������ 62.5
������ 62.5
��������
��KNO3 ���ɽ������ӣ�K+����������ӣ�NO3-����ɣ������Σ�
��KNO3 ������ɫ��Ӧ������ɫ�ܲ����۲쵽�������ɫ��
��I �����ܽ�ȱ���֪��30��ʱ��KNO3 ���ܽ����45.8g/100gˮ��
II ��Һ�ﵽ����״̬ʱ���������������ﵽ���ֵ��һ���¶��±�����Һ�����ʷ���=![]() �������ܽ�ȱ���֪��50��ʱ��KNO3 ���ܽ����85.5g/100gˮ��50��ʱ��KNO3 ��Һ�����������������ֵ��
�������ܽ�ȱ���֪��50��ʱ��KNO3 ���ܽ����85.5g/100gˮ��50��ʱ��KNO3 ��Һ�����������������ֵ��![]() ��
��
III 70�潵�µ�60�棬�������������28g��70���60��������ܽ�Ȳ�=138g-110g=28g�������ܽ�ȸ����֪����Һ�е��ܼ�����Ϊ100g��80�潵��70��ʱ������Һ����Ӧ������169g-138g=31g>10g������80��ʱ��KNO3��Һ�Dz�������Һ�����������������Ϊ��n=38g+��110g-85.5g��=62.5g��

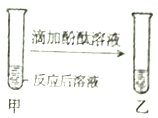
����Ŀ��С�������������к��������ơ���ʵ��ʱ��ʵ��ǰ����������������Һ�еμӷ�̪��Һ���������ж��кͷ�Ӧ���еij̶ȣ�����С���Է�Ӧ����Һ������Խ�����̽����
��̽��Ŀ����ȷ����Ӧ����Һ�������
����������衿��Ӧ����Һ�ʼ��ԣ�Ҳ���ܳ�_____��Ҳ���ܳ�_____��
��ʵ����֤��
ʵ����� | ʵ������ | ʵ����� |
| ��ɫ��̪��Һ______ | ��Һ�ʼ��ԣ�ʹ��ʼ��Ե�����_____ |
��ɫ��̪��Һ����ɫ | ��Һ��______ |
��������֤��
ʵ����� | ʵ������ | ʵ����� |
| ��ĩ���ֻ�ȫ����ʧ����Һ��Ϊ��ɫ | ��Һ��_____����Ӧ�Ļ�ѧ����ʽ��_____ |
____________ | ��Һ��______ |
����Ŀ��С��Ϊ�˲ⶨʵ�������������Ʒ�Ĵ��ȣ�ȡ10g��Ʒ��1g�������̻�ϣ����μ��ȸû����t1��t2��t3��t4ʱ��ֱ���ȴ����ʣ�������������¼���й��������±�����Ʒ�е����ʲ����뻯ѧ��Ӧ��
����ʱ�� | t1 | t2 | t3 | t4 |
ʣ�����������g�� | 9.68 | 9.04 | 7.16 | 7.16 |
�Լ��㣺
��1����ȫ��Ӧ�������������������Ϊ_____________g��
��2����Ʒ������صĴ�����____��д��������̣�
��3������ʱ��t1��9.68gʣ������г���������е�����Ϊ_____________��