题目内容
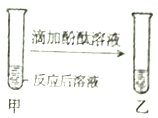
【题目】小明在做“盐酸中和氢氧化钠”的实验时,实验前忘记向氢氧化钠溶液中滴加酚酞溶液,导致无法判断中和反应进行的程度,于是小明对反应后溶液的酸碱性进行了探究。
【探究目的】确定反应后溶液的酸碱性
【猜想与假设】反应后溶液呈碱性,也可能呈_____,也可能呈_____。
【实验验证】
实验操作 | 实验现象 | 实验结论 |
| 无色酚酞溶液______ | 溶液呈碱性,使其呈碱性的微粒是_____ |
无色酚酞溶液不变色 | 溶液呈______ |
【继续验证】
实验操作 | 实验现象 | 实验结论 |
| 粉末部分或全部消失.溶液变为黄色 | 溶液呈_____,反应的化学方程式是_____ |
____________ | 溶液呈______ |
【答案】【猜想与假设】中性(或酸性) 酸性或(中性)
【实验验证】变红;OH-;中性(或酸性)
【继续验证】酸性;Fe2O3+6HCl=2FeCl3+3H2O;
无明显现象;中性
【解析】【猜想与假设】盐酸中和氢氧化钠刚好完全反应时,溶质只有氯化钠,溶液呈中性,盐酸过量时溶质为氯化钠和氯化氢,溶液呈酸性;氢氧化钠过量时,溶质为氯化钠和氢氧化钠,溶液呈碱性; 【实验验证】酚酞试液遇碱性溶液变红,遇酸性溶液或中性溶液不变色;溶液呈碱性的实质是有氢氧根离子;呈酸性的实质是有氢离子;【继续验证】氧化铁能与盐酸反应生成黄色的氯化铁溶液,反应方程式为Fe2O3+6HCl=2FeCl3+3H2O;如果没有盐酸,加入氧化铁后不发生化学反应,无明显现象;证明溶液呈中性

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目