题目内容
(3分)已知金属钠与水在常温下反应的化学方程式为:2Na + 2H2O="=2NaOH" + H2↑。若要得到2 g氢气,需要金属钠多少克?
46 g
试题分析:根据题给的化学方程式,利用氢气与钠的质量比,结合氢气的质量,即可求出需要金属钠的质量。
解:设需要金属钠的质量为x。
2Na +2 H2O= 2NaOH + H2 ↑
46 2
x 2 g
46∶2 =" x∶2" g
解得x =" 46" g
答:需要金属钠的质量为46 g。
点评:本题为根据化学方程式计算类问题中的简单计算,完整的计算步骤、规范的书写格式,是解答此类问题的关键。

练习册系列答案
相关题目
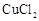 除去,同时测出其中所含
除去,同时测出其中所含