题目内容
老师要求同学们将30g NaCl样品中的杂质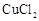 除去,同时测出其中所含
除去,同时测出其中所含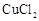 的质量分数。提供的试剂有:一定质量分数的NaOH溶液、KOH溶液、稀盐酸各100g。小林同学顺利完成了任务。她的方法是:将30g NaCl样品加入100g水中,固体全部溶解后再逐渐加入所选试剂,当加入的试剂质量为56g时,恰好完全反应,测得生成沉淀的质量为4.9g。请回答:
的质量分数。提供的试剂有:一定质量分数的NaOH溶液、KOH溶液、稀盐酸各100g。小林同学顺利完成了任务。她的方法是:将30g NaCl样品加入100g水中,固体全部溶解后再逐渐加入所选试剂,当加入的试剂质量为56g时,恰好完全反应,测得生成沉淀的质量为4.9g。请回答:
(1)小林同学所选用的试剂是 。
(2)该NaCl样品中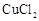 的质量分数是多少?
的质量分数是多少?
(3)当恰好完全反应时,所得溶液的质量是多少?
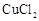 除去,同时测出其中所含
除去,同时测出其中所含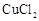 的质量分数。提供的试剂有:一定质量分数的NaOH溶液、KOH溶液、稀盐酸各100g。小林同学顺利完成了任务。她的方法是:将30g NaCl样品加入100g水中,固体全部溶解后再逐渐加入所选试剂,当加入的试剂质量为56g时,恰好完全反应,测得生成沉淀的质量为4.9g。请回答:
的质量分数。提供的试剂有:一定质量分数的NaOH溶液、KOH溶液、稀盐酸各100g。小林同学顺利完成了任务。她的方法是:将30g NaCl样品加入100g水中,固体全部溶解后再逐渐加入所选试剂,当加入的试剂质量为56g时,恰好完全反应,测得生成沉淀的质量为4.9g。请回答:(1)小林同学所选用的试剂是 。
(2)该NaCl样品中
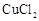 的质量分数是多少?
的质量分数是多少?(3)当恰好完全反应时,所得溶液的质量是多少?
(1)氢氧化钠溶液 (2)22.5% (3)181.1g
试题分析:(1)根据除杂的原则,所选的物质要与氯化铜发生反应而不与氯化钠发生反应,在除去氯化铜的同时还不能混入其它杂质;氢氧化钠与氯化钠不反应,氢氧化钠与氯化铜反应生成氢氧化铜沉淀和氯化钠,使用氢氧化钠溶液可以在除去氯化铜的同时又得到主要物质氯化钠,可以达到实验目的;若使用氢氧化钾,氢氧化钾与氯化铜反应生成氢氧化铜沉淀和氯化钾,在除去氯化铜的同时又混入新杂质氯化钾;若使用稀盐酸,盐酸与杂质氯化铜不反应,无法除杂;故选氢氧化钠溶液。
(2)根据题意,写出氯化铜与氢氧化钠反应的化学方程式,再根据氢氧化铜沉淀的质量求出氯化铜的质量,最后利用样品中氯化铜的质量分数=
 ×100%,即可求出氯化钠样品中氯化铜的质量分数。
×100%,即可求出氯化钠样品中氯化铜的质量分数。解,设氯化铜的质量为x
CuCl2+2NaOH=2NaCl+Cu(OH)2↓
135 98
x 4.9g
135:x="98:4.9g"
解得,x=6.75g
则该NaCl样品中CuCl2的质量分数=
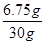 ×100%="22.5%"
×100%="22.5%" (3)根据题意,当恰好完全反应时,所得溶液为氯化钠溶液,所得溶液的质量=所加的所有物质的总质量-生成沉淀的质量,故所得溶液的质量=30g+100g+56g-4.9g=181.1g
答:当恰好完全反应时,所得溶液的质量为181.1g。
点评:一般的除杂质题必须同时满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应,②反应时不能加入新的杂质,这是正确解题的关键;至于根据化学方程式的计算,本题较简单,只要会利用相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意要有完整的计算步骤和规范的书写格式。

练习册系列答案
相关题目





 2N2+3H2O。若反应后得到28 gN2,理论上消耗氨气多少克?
2N2+3H2O。若反应后得到28 gN2,理论上消耗氨气多少克?