题目内容
碳酸钠俗称纯碱、苏打。某工业纯碱中含有质量的杂质氯化钠,化学兴趣小组的同学们通过如下实验测定了该纯碱的纯度。称取20g纯碱样品,放入盛有100g稀盐酸的烧杯中,二者恰好完全反应,反应后称得烧杯中溶液的质量为113.4g。请计算:
(1)生成二氧化碳的质量;
(2)纯碱样品中碳酸钠的质量分数(精确到0.1%))。
(1)生成二氧化碳的质量;
(2)纯碱样品中碳酸钠的质量分数(精确到0.1%))。
(8分)⑴生成二氧化碳气体的质量:100g+20g-113.4g=6.6g
⑵解:设纯碱样品中碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 6.6g
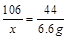
x=15.9g
纯碱样品中碳酸钠的质量分数: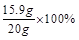 =79.5%
=79.5%
⑵解:设纯碱样品中碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 6.6g
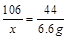
x=15.9g
纯碱样品中碳酸钠的质量分数:
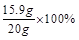 =79.5%
=79.5%(1)根据质量守恒定律,反应前后烧杯中物质减轻的质量即生成的二氧化碳气体的质量,所以生成二氧化碳气体的质量为:20g+100g-113.4g=6.6。
(2)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,(1)中已求出二氧化碳的质量,根据碳酸钠和稀盐酸反应的化学方程式求出碳酸钠的质量除以纯碱样品的质量即可求解。
(2)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,(1)中已求出二氧化碳的质量,根据碳酸钠和稀盐酸反应的化学方程式求出碳酸钠的质量除以纯碱样品的质量即可求解。

练习册系列答案
相关题目

 CO+H2.若生产1t氢气,计算所需碳的质量.
CO+H2.若生产1t氢气,计算所需碳的质量.

