题目内容
【题目】下列实验不能达到实验目的是( )
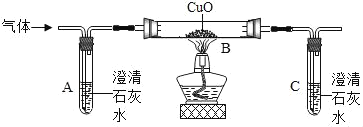
A.  除去实验室制得二氧化碳气体中的氯化氢和水蒸气,得到纯净、干燥的二氧化碳
除去实验室制得二氧化碳气体中的氯化氢和水蒸气,得到纯净、干燥的二氧化碳
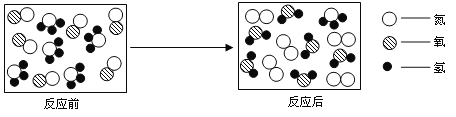
B.  验证水是由氢元素和氧元素组成的
验证水是由氢元素和氧元素组成的
C. 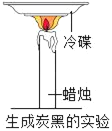 探究蜡烛中含有碳元素
探究蜡烛中含有碳元素
D. 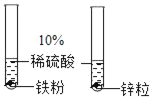 证明锌的金属活动性比铁活泼
证明锌的金属活动性比铁活泼
【答案】D
【解析】
A、碳酸氢钠溶液可吸收氯化氢气体,浓硫酸具有吸水性,可用于除去混合气体中的水蒸气,要注意除水蒸气要放在最后去除,否则会再次引入水蒸气,故选项实验能达到实验目的。
B、电解水时,与电源负极相连的试管内的气体体积多,是氢气;与电源正极相连的试管内产生的气体体积少,是氧气;两者的体积之比大约是2:1;电解水得到氢气和氧气,氢气、氧气分别是由氢元素、氧元素组成的,则说明了水由氢元素、氧元素组成的,故选项实验能达到实验目的。
C、蜡烛不充分燃烧时生成一氧化碳和黑色的炭黑,用一只冷碟子放在蜡烛火焰上方,能获得炭黑,反应物氧气中只含有氧元素,由质量守恒定律,可探究蜡烛中含有碳元素,故选项实验能达到实验目的。
D、由于锌和铁的形状不同,不能证明锌的金属活动性比铁活泼,故选项实验不能达到实验目的。
故选:D。

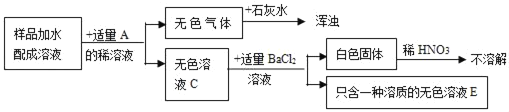
【题目】实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
(一)定性探究:
Ⅰ.称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含____;
Ⅱ.取Ⅰ中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
操作 | 现象 | 结论 |
向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有____ |
取上层清液,滴加____ | ____ | 原固体中不含NaOH |
其中,步骤加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是____;
Ⅲ.再取Ⅰ中得到的滤液少量,进行如下操作:
![]()
同学们认为:原固体中一定含有NaCl。但是老师指出这个结论不正确,其理由是___(填序号)
A.滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B.滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
(二)定量探究:
在老师的指导下同学们又精确称量了10g原固体,进行如下实验:
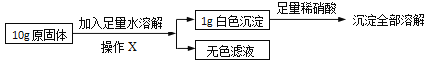
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是____,则原固体中一定不含____;其中,操作X的名称是____,无色滤液中一定含有的阳离子是____。
试根据生成沉淀的质量计算原固体中氯化钙的质量分数,写出计算过程_____。